题目内容
17.在容积固定的容器中发生反应:A(g)+2B(g)═C (g)△H<0,各物质浓度如表所示:| 浓度 时间 | c(A)/mol•L-1 | c(B)/mol•L-1 | c(C)/mol•L-1 |
| 0 | 0.8 | 1.6 | 0 |
| 2min | 0.6 | x | 0.2 |
| 4min | 0.3 | 0.6 | 0.5 |
| 6min | 0.3 | 0.6 | 0.5 |
| A. | 2~4 min内用B表示的平均反应速率为0.3 mol•L-1•min-1 | |
| B. | 反应在第2 min时改变了条件,可能是加入了催化剂 | |
| C. | 反应在第2 min时改变了条件,可能是增加了B的浓度 | |
| D. | 若加入催化剂,平衡时气体混合物的总物质的量保持不变 |
分析 A、依据化学反应速率概念计算,单位时间内物质浓度变化计算反应速率;
B、反应在第2min时改变了条件,催化剂加快反应速率;
C、反应在第2min时改变了条件,催化剂加快反应速率;
D、催化剂只改变反应速率,不改变平衡移动.
解答 解:A、2min-4min内,依据图表可知x=1.2mol/L,B消耗浓度为0.6mol/L,用B表示的速率=$\frac{0.6mol/L}{2min}$=0.3mol/(L•min),故A正确;
B、依据图表数据分析,2min时A浓度变化为0.2mol/L,2min到4minA浓度变化为0.3mol/L,说明反应速率增大,可能是加入了催化剂,故B正确;
C、依据图表数据分析,2min时A浓度变化为0.2mol/L,2min到4minA浓度变化为0.3mol/L,说明反应速率增大,可能是加入了催化剂,故C错误;
D、催化剂只改变反应速率,不改变平衡移动,所以加入催化剂,平衡时气体混合物的总物质的量保持不变,故D正确;
故选C.
点评 本题考查了化学平衡的影响因素分析,数据分析利用的能力,反应速率的计算应用,题目难度中等.

练习册系列答案
相关题目
7.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电.下列有关分析正确的是( )
| A. | K3C60和C60中都含有共价键 | |
| B. | 钾的核外电子排布为:1s22s22p63s23p63d104s1 | |
| C. | K3C60和C60都属于分子晶体,具有较低的熔点 | |
| D. | C60与12C互为同素异形体 |
8.取c(H+)均为0.5mol/L的盐酸和醋酸各100mL,分别加水稀释两倍后,再分别加入0.65g锌粉,相同条件下充分反应,下列说法中,正确的是( )
| A. | 将锌反应完所需的时间相同 | B. | 起始时醋酸与锌反应的速率大 | ||
| C. | 醋酸与锌反应放出的氢气多 | D. | 两者放出的氢气一样多 |
12.1000K时,反应C(s)+2H2(g)═CH4(g)的 K=8.28×107,当各气体物质的量浓度分别为H20.7mol•L-1、CH4 0.2mol•L-1时,上述平衡( )
| A. | 向正反应方向移动 | B. | 向逆反应方向移动 | ||
| C. | 达到平衡 | D. | 无法判断移动方向 |
2.下列溶液中,Na+的物质的量浓度最大的是( )
| A. | 5 mL 0.6mol•L-1 Na2SO4溶液 | B. | 10 mL 0.3 mol•L-1 Na3PO4溶液 | ||
| C. | 5 mL 0.4 mol•L-1 NaOH溶液 | D. | 10mL 0.5 mol•L-1 NaNO3溶液 |
6.在配制一定物质的量浓度的溶液的实验中,下列操作正确的是( )
| A. | 欲配制1000mL 0.1mol•L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线2cm时,再用胶头滴管加水至刻度线 | |
| B. | 将准确量取的18.4mol•L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线,即可制得100mL稀硫酸 | |
| C. | 仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 | |
| D. | 将氢氧化钠固体放在有滤纸的天平托盘上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
18.关于如图各装置图的叙述中,符合实验安全且能达到实验目的是( )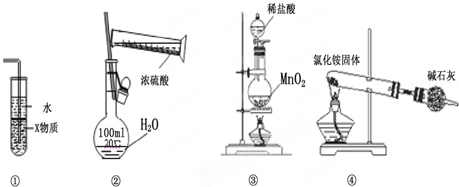

| A. | 装置中①X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 | |
| B. | 装置②可用于实验室配制一定物质的量浓度的稀硫酸 | |
| C. | 实验室用装置③制取氯气 | |
| D. | 实验室用装置④制取氨气 |
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.