题目内容
14. 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓盐酸的物质的量浓度为12mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配制250mL物质的量浓度为0.7mol/L稀盐酸.
①该学生用量筒量取14.6 mL上述浓盐酸进行配制;
②所需的实验仪器有:胶头滴管、烧杯、量筒、玻璃棒,配制稀盐酸时,还缺少的仪器有250mL容量瓶.
③下列操作导致所配制的稀盐酸的物质的量浓度偏低的是ADE (填字母).
A、用量筒量取浓盐酸时俯视凹液面
B、未恢复到室温就将溶液注入容量瓶并进行定容
C、容量瓶用蒸馏水洗后未干燥
D、定容时仰视液面
E、未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为dmol/L.
a.$\frac{36.5a}{22.4(a+1)d}$ b.$\frac{1000ad}{36.5+22.4}$ c.$\frac{ad}{36.5+22400}$ d.$\frac{1000ad}{36.5+22400}$.
分析 (1)根据c=$\frac{1000ρω}{M}$计算该浓盐酸中HCl的物质的量浓度;
(2)①根据溶液稀释定律C浓V浓=C稀V稀来计算;
②根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
③根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(3)根据n=$\frac{V}{{V}_{m}}$计算氯化氢气体的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液的体积,根据c=$\frac{n}{V}$计算该盐酸的物质的量浓度.
解答 解:(1)浓盐酸中HCl的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.2×36.5%}{36.5}$=12mol/L,故答案为:12
(2)①设所需要的浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:12mol/L×VmL=0.7mol/L×250mL
解得V=14.6mL,故答案为:14.6;
②根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为:胶头滴管、烧杯、量筒、玻璃棒、250mL容量瓶,故还缺少250mL容量瓶,故答案为:250mL容量瓶;
③A、用量筒量取浓盐酸时俯视凹液面,会导致所量取的浓盐酸的体积偏小,则所配溶液的浓度偏低,故A正确;
B、未恢复到室温就将溶液注入容量瓶并进行定容,待恢复至室温时溶液体积偏小,则浓度偏高,故B错误;
C、若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故C错误;
D、定容时仰视液面,则溶液体积偏大,浓度偏低,故D正确;
E、未洗涤烧杯和玻璃棒,会导致溶质的损失,则浓度偏低,故E正确.
故答案为:ADE.
(3)解:HCl的物质的量为$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,HCl的质量为$\frac{a}{22.4}$mol×36.5g/mol=$\frac{36.5a}{22.4}$g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为($\frac{36.5a}{22.4}$+1000)g,溶液的体积为$\frac{(\frac{36.5a}{22.4}+1000)g}{1000dg/L}$=$\frac{36.5a+22400}{22400d}$L,故所得溶液的物质的量浓度为$\frac{\frac{a}{22.4}mol}{\frac{36.5a+22400}{22400d}L}$=$\frac{1000da}{36.5a+22400}$mol/L,
故选D.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

| A. | 胶体中分散质的颗粒大小在10-9~10-7m之间 | |
| B. | 胶体的外观是不均匀的 | |
| C. | 将一束激光照射到胶体中会发现一条光亮的通路 | |
| D. | 胶体可能有不同的颜色 |
| A. | 氢氧化钠溶液 | B. | 稀硫酸 | C. | 稀盐酸 | D. | 稀硝酸 |
| A. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | pH<7的溶液中:SO42-、CO32-、Na+、K+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- |
| A. | 1000 mL,111.2 g | B. | 950 mL,111.2 g | ||
| C. | 任意规格,117.0 g | D. | 1000 mL,117.0 g |
| A. | 制半导体元素 | B. | 制农药元素 | ||
| C. | 制催化剂元素 | D. | 制耐高温合金的元素 |
| A. | 平衡可能向逆反应方向移动 | B. | 混合气体的密度一定增大 | ||
| C. | 容器内混合气体的颜色变浅 | D. | 正,逆反应速率一定加快 |
| A. | 减少氟氯烃的排放量 | B. | 减少含铅废气的排放量 | ||
| C. | 减少二氧化硫的排放量 | D. | 减少二氧化碳的排放量 |
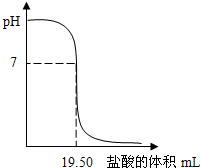 25℃时,用0.1000mol/LHCl滴定20.00mL未知浓度的NaOH溶液,得到如图所示的酸碱滴定曲线;根据曲线可查出pH=7时,所消耗的盐酸溶液体积为19.50mL.回答下列问题:
25℃时,用0.1000mol/LHCl滴定20.00mL未知浓度的NaOH溶液,得到如图所示的酸碱滴定曲线;根据曲线可查出pH=7时,所消耗的盐酸溶液体积为19.50mL.回答下列问题: