题目内容
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
(1)上述三种酸中一定属于强酸的是___________;
(2)丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-) = mol/L;
(3)甲组中x的值_____7(填>、<、=);
(4)部分实验反应过程中的pH变化曲线如下图:
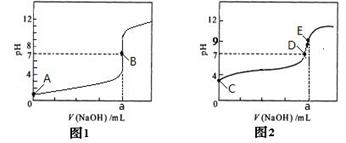
①表示乙组实验的pH变化曲线是________________
②上图中表示溶液呈中性的点为_________,表示溶液恰好完全反应的点是_______
③E点对应离子浓度由大到小的顺序为 。
| 组别 | c(一元酸) | c(NaOH) /mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1 mol/L | 0.1 | pH = x |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH = 7 |
| 丙 | c(HZ)=0.1 mol/L | 0.1 | pH = 9 |
(1)上述三种酸中一定属于强酸的是___________;
(2)丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-) = mol/L;
(3)甲组中x的值_____7(填>、<、=);
(4)部分实验反应过程中的pH变化曲线如下图:

①表示乙组实验的pH变化曲线是________________
②上图中表示溶液呈中性的点为_________,表示溶液恰好完全反应的点是_______
③E点对应离子浓度由大到小的顺序为 。
(1)HY (1分)
(2)HZ +OH- → H2O + Z-(2分), 1×10-5(2分)
(3)≧7(2分)
(4)①图1(1分) ②BD,B E(各1分,共2分)
③c(Na+) > c(Z-) > c(OH-) > c(H+)(2分)
(2)HZ +OH- → H2O + Z-(2分), 1×10-5(2分)
(3)≧7(2分)
(4)①图1(1分) ②BD,B E(各1分,共2分)
③c(Na+) > c(Z-) > c(OH-) > c(H+)(2分)
试题分析:(1)乙选项中由PH=7可以判断出溶液呈中性,也就是说生成的盐是强酸强碱盐,故HY为强酸;
(2)由PH=9说明生成强碱弱酸盐,所以组实验发生反应的离子方程式为HZ +OH- → H2O + Z-,HZ为弱酸要写成化学式不能拆。由PH=9可知H+浓度为10-9,由于一部分氢离子和弱酸根离子结合了,故剩余的H+为10-9,则由水电离出的 OH-为10-5mol/L;
(3)HX若是强酸则PH=7,若是弱酸,则PH.>7;
(4)乙组溶液呈中性,故为图1;表示溶液恰好完全反应的点有B,D, E,完全反应溶液不一定呈中性;由于是等体积混合,由图中可知PH>7说明混合后呈碱性,可知溶液中离子的关系为c(Na+) > c(Z-) > c(OH-) > c(H+)。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
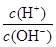 =1×1014的溶液:Ba2+、Na+、SO32-、NO3-
=1×1014的溶液:Ba2+、Na+、SO32-、NO3-