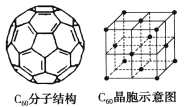
题目内容
【题目】在标准状况下,4.48 L的NH3气体物质的量为________mol质量为________g,其中含________个氢原子(用NA表示),将其溶于水配成200 mL的溶液,其物质的量浓度为________mol/L,若将标准状况下,4.48 L的NH3气体与0.3 mol的CH4混合,相同条件下,该混合气体对H2的相对密度为______________。
【答案】0.2 3.4 0.6NA 1 8.2
【解析】
本题主要考查关于物质的量的计算。
在标准状况下,4.48L的NH3气体物质的量为n=![]() =
=![]() =0.2mol,质量为m=nM=0.2mol×17g/mol=3.4g,其中含0.2NA×3=0.6NA个氢原子,将其溶于水配成200 mL的溶液,其物质的量浓度为c=
=0.2mol,质量为m=nM=0.2mol×17g/mol=3.4g,其中含0.2NA×3=0.6NA个氢原子,将其溶于水配成200 mL的溶液,其物质的量浓度为c=![]() =
=![]() =1mol/L,若将标准状况下,4.48L的NH3气体与0.3mol的CH4混合,混合气体的相对分子质量为(0.2×17+0,3×16)/(0.2+0.3)=16.4,相同条件下,相对分子质量之比等于密度之比,所以该混合气体对H2的相对密度为16.4/2=8.2。
=1mol/L,若将标准状况下,4.48L的NH3气体与0.3mol的CH4混合,混合气体的相对分子质量为(0.2×17+0,3×16)/(0.2+0.3)=16.4,相同条件下,相对分子质量之比等于密度之比,所以该混合气体对H2的相对密度为16.4/2=8.2。

【题目】下列实验操作、现象及所得出的结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向盐酸中滴加Na2SO3溶液 | 产生使品红溶液褪色的气体 | 非金属性:Cl>S |
B | 向废FeCl3蚀刻液X中加入少量的铁粉,振荡 | 未出现红色固体 | X中一定不含Cu2+ |
C | 用c(Fe3+)相同的Fe2(SO4)3和FeCl3溶液,分别清洗做完银镜反应的试管 | FeCl3溶液清洗得较干净 | Fe3++Ag |
D | 用3 mL稀硫酸与纯锌粒反应,再加入几滴 Cu(NO3)2浓溶液 | 迅速产生无色气体 | 形成Zn-Cu原电池加快了制取H2的速率 |
A. A B. B C. C D. D