题目内容
5. 1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应:
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应: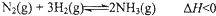 模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.回答下列问题:
(1)已知:①
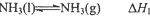
②

则反应
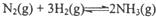 的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).
的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).(2)合成氨的平衡常数表达式为$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,平衡时,M点NH3的体积分数为10%,则N2的转化率为18%(保留两位有效数字)
(3)X轴上a点的数值比b点小(填“大”或“小”).上图中,Y轴表示温度(填“温度”或“压强”),判断的理由是随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,故Y为温度.
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Ql<Q2 B.N2的转化率:I>III
C.平衡常数:II>I D.达平衡时氨气的体积分数:I>II
(5)下列能提高N2的转化率的是C
A.升高温度 B.恒容体系中通入N2气体
C.分离出NH3 D.通入稀有气体He,使体系压强增大到原来的5倍
(6)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l 的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)>c(S042-)(填“>”、“<”或“=”).
(7)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-.写出负极的电极反应式2NH3+3O2--6e-=N2+3H2O.
分析 (1)根据盖斯定律,①×2+②可得③,反应热也进行相应计算;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
设转化的氮气为xmol,表示出平衡时各物质的物质的量,再根据M点NH3的体积分数为10%列方程计算解答;
(3)随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,正反应为体积减小的放热反应,故Y为温度,则X为压强,增大压强平衡正向移动,φ(NH3)增大;
(4)A.I为恒温恒容,随反应进行压强减小,Ⅱ为恒温恒压,Ⅱ等效为在I的基础上增大压强,平衡正向移动,Ⅱ中反应物转化率大于Ⅰ;
B.Ⅲ为恒容绝热,随反应进行温度升高,I为恒温恒容,Ⅲ等效为在I的基础上升高温度,平衡逆向移动;
C.平衡常数只受温度影响,温度相同,平衡常数相同;
D.Ⅱ等效为在I的基础上增大压强,平衡正向移动,氨气体积分数增大;
(5)提高N2的转化率,应改变条件使平衡正向移动,但不能只增大氮气浓度,否则氮气转化率会降低;
(6)溶液呈中性,则c(H+)=c(OH-),根据电荷守恒:c(NH4+)+c(H+)=2c(SO42-)+c(OH-);
(7)原电池负极发生氧化反应,氨气在负极失去电子,与电解质氧化传导的O2-结合生成氮气与水.
解答 解:(1)已知:①NH3(l)?NH3(g)△H1
②N2(g)+3H2(g)?2NH3(l)△H2
根据盖斯定律,①×2+②可得:N2(g)+3H2(g)?2NH3(g),故△H=2△H1+△H2,
故答案为:2△H1+△H2;
(2)反应N2(g)+3H2(g)?2NH3(g)的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
设转化的氮气为xmol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
转化量(mol):x 3x 2x
平衡量(mol):1-x 3-3x 2x
所以$\frac{2x}{4-2x}$=10%,解得x=$\frac{2}{11}$mol,故氮气转化率为$\frac{\frac{2}{11}mol}{1mol}$×100%=18%,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;18%;
(3)随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,正反应为体积减小的放热反应,故Y为温度,则X为压强,增大压强平衡正向移动,φ(NH3)增大,a点的数值比b点小,
故答案为:小;随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,故Y为温度;
(4)A.I为恒温恒容,随反应进行压强减小,Ⅱ为恒温恒压,Ⅱ等效为在I的基础上增大压强,平衡正向移动,Ⅱ中反应物转化率大于Ⅰ,放出热量:Ql<Q2,故A正确;
B.Ⅲ为恒容绝热,随反应进行温度升高,I为恒温恒容,Ⅲ等效为在I的基础上升高温度,平衡逆向移动,N2的转化率:I>III,故B正确;
C.平衡常数只受温度影响,温度相同,平衡常数相同,则平衡常数:II=I,故C错误;
D.Ⅱ等效为在I的基础上增大压强,平衡正向移动,则达平衡时氨气的体积分数:I<II,故D错误,
故选:AB;
(5)A.正反应为放热反应,升高温度,平衡逆向移动,氮气的转化率减小,故A错误;
B.恒容体系中通入N2气体,氮气的转化率减小,故B错误;
C.分离出NH3,平衡正向移动,氮气转化率增大,故C正确;
D.通入稀有气体He,使体系压强增大到原来的5倍,各组分浓度不变,平衡不移动,氮气转化率不变,故D错误,
故选:C;
(6)溶液呈中性,则c(H+)=c(OH-),根据电荷守恒:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),则c(NH4+)>c(SO42-),
故答案为:>;
(7)原电池负极发生氧化反应,氨气在负极失去电子,与电解质氧化传导的O2-结合生成氮气与水,负极电极反应式为:2NH3+3O2--6e-=N2+3H2O,
故答案为:2NH3+3O2--6e-=N2+3H2O.
点评 本题考查化学平衡计算与影响因素、反应热计算、离子浓度比较、原电池等,题目比较综合,需要学生具备扎实的基础与灵活应用能力,难度中等.

( )
| A. | 2Fe2十+Cl2═2Fe3++2Cl- | B. | 2Fe2十+O2═2Fe3++2I- | ||
| C. | I2+SO2+2H2O═H2SO4+2HI | D. | SO2+O2+2H2O═H2O2+H2SO4 |
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | D、B简单离子半径大小关系为D3+>B2+ | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | 最高价氧化物对应的水化物的酸性:H2EO4>HFO4 | |
| D. | 气态氢化物的稳定性HG>HF>H2E |

| A. | AB为气体,A2,B2均为气体 Q>0 | |
| B. | AB为气体,A2,B2其中有一种为气体,Q<0 | |
| C. | AB为气体,A2,B2其中有一种为气体,Q>0 | |
| D. | AB为气体,A2,B2其中至少有一种为气体,Q>0 |
| A. | 含最高价元素的化合物,一定具有氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子越多,还原性越强 | |
| D. | 一种物质是氧化剂时,同时必然有另一种物质是还原剂 |
| A. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=+725.8kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1451.6kJ/mol | |
| C. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=-725.8kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=+1451.6kJ/mol |