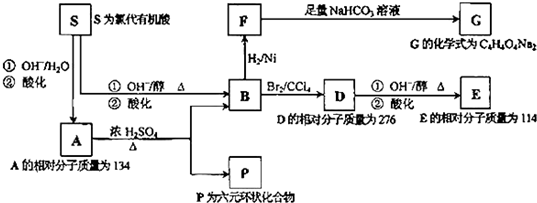
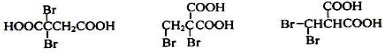
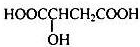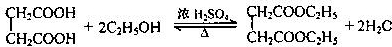题目内容
(2008?天津)下列叙述正确的是( )
分析:A.根据1个单键就是一对公用电子对,一个双键就是就是两对公用电子对;
B.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6;
C.H2S是含极性键的极性分子;CS2分子都是含极性键的非极性分子;
D.原子晶体的熔沸点的高低取决于比较共价键的强弱:原子半径越小,共价键越短,键能越大,熔沸点越高.
B.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6;
C.H2S是含极性键的极性分子;CS2分子都是含极性键的非极性分子;
D.原子晶体的熔沸点的高低取决于比较共价键的强弱:原子半径越小,共价键越短,键能越大,熔沸点越高.
解答:解:A.1个甘氨酸 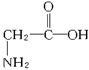 含有8个单键,1个双键,所以分子中存在10对共用电子,故A错误;
含有8个单键,1个双键,所以分子中存在10对共用电子,故A错误;
B.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6,Cl原子的最外层电子数为8,故B错误;
C.H2S是含极性键的极性分子,CS2分子都是含极性键的非极性分子,故C错误;
D.因为碳原子半径小于硅原子半径,所以C-C的键长<C-Si<Si-Si所以金刚石、碳化硅、晶体硅的熔点由高到低的顺序为金刚石>碳化硅>晶体硅,故D正确;
故选D.
 含有8个单键,1个双键,所以分子中存在10对共用电子,故A错误;
含有8个单键,1个双键,所以分子中存在10对共用电子,故A错误;B.PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6,Cl原子的最外层电子数为8,故B错误;
C.H2S是含极性键的极性分子,CS2分子都是含极性键的非极性分子,故C错误;
D.因为碳原子半径小于硅原子半径,所以C-C的键长<C-Si<Si-Si所以金刚石、碳化硅、晶体硅的熔点由高到低的顺序为金刚石>碳化硅>晶体硅,故D正确;
故选D.
点评:本题主要考查考查了分子内的共价键、分子的极性、原子晶体熔点的比较,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目