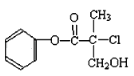
题目内容
【题目】LED(Light EmittingDiode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )
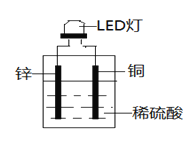
A. 溶液中SO42-向铜片附近移动
B. 铜片上发生的反应为2H++2e-=H2↑
C. 导线中电子由锌片流向铜片
D. 如果将锌片换成铁片,则电路中的电流方向不变
【答案】A
【解析】
锌比铜活泼,形成原电池时,锌为负极,铜为正极,负极上锌发生氧化反应,逐渐溶解,正极发生还原反应,生成氢气,结合原电池原理分析解答。
A.Zn、Cu和稀硫酸构成原电池,锌为负极,铜为正极,电解质溶液中的SO42-向负极(锌片)移动,故A错误;
B.铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,电极反应式为:2H++2e-=H2,故B正确;
C.Zn、Cu和稀硫酸构成原电池,锌为负极,铜为正极,电子从负极锌沿导线流向正极铜,故C正确;
D.金属性Cu比Zn、Fe弱,Cu作正极,所以电路中的电流方向不变,仍然由Cu流向负极,故D正确;
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥纯净的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | 与过量氯气发生S2Cl2+Cl2 |
设计实验装置图如下:

(1)仪器A的名称是______________。
B中反应的离子方程式为_________________________________。
(2) S2Cl2遇水会生成黄色单质、一种能使品红溶液褪色的气体化合物及酸雾,D中的试剂应是________,写出该反应的化学方程式__________________ 。
(3)装置H的作用是_______________ ,其中发生反应的化学方程式为 ______________________。
(4)S2Cl2粗品中可能混有的杂质是SCl2、Cl2、S,为了提高S2Cl2的纯度,关键的操作是控制好温度和_______。