题目内容
请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为 ,质量之比为 。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为 g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1 ,则:
①该气体的物质的量为 mol。
②该气体在标准状况下的体积为 L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为 mol/L。
(4)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是 mol/L。
(5)用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2 三种溶液中的SO42-恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为 。
(1)3∶4 4∶5 (2)8
(3)① ②
② ③
③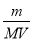 (4)
(4) (5)2∶6∶3
(5)2∶6∶3
【解析】
试题分析:(1)SO2是由3个原子构成的,三氧化硫是由4个原子构成的,所以当SO2和SO3中分子个数比为1∶1 时,原子总数之比为3∶4;质量之比为64:80=4∶5。
(2)根据方程式HCl+NaOH=NaCl+H2O可知,中和含0.2 mol HCl的稀盐酸,需NaOH的物质的量是0.2mol,其质量=0.2mol×40g/mol=8.0g。
(3)m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1 ,则:
①根据n= 可知,该气体的物质的量为
可知,该气体的物质的量为 mol。
mol。
②根据n= 可知,该气体在标准状况下的体积为
可知,该气体在标准状况下的体积为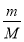 mol×22.4L/mol=
mol×22.4L/mol= L。
L。
③该气体溶于水后形成V L溶液(不考虑反应),则根据c= 可知,其溶液的物质的量浓度为
可知,其溶液的物质的量浓度为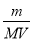 mol/L。
mol/L。
(4)5mol/L的Mg(NO3)2溶液中NO3-的物质的量浓度是5mol/L×2=10mol/L,根据稀释过程中溶质质量不变可知,如果将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是 mol/L。
mol/L。
(5)用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2 三种溶液中的SO42-恰好完全沉淀,则根据离子反应Ba2++SO42-=BaSO4↓可知,相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2 三种溶液中的SO42-的浓度相同,都是0.1mol/L,所以三种硫酸盐的物质的量浓度之比为 :0.1:
:0.1:  =2∶6∶3。
=2∶6∶3。
考点:考查物质的量、气体摩尔体积、物质的量浓度的有关计算
