题目内容
(10分)
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是 。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是 _______。(填序号)
① NaAlO2 ② Ca(OH)2 ③Na2CO3 ④Al(OH)3
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是
;过一会儿,溶液颜色逐渐褪去,起作用的成分是 ;
(4)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式 。
(1) H2 (2)④ (3)HCl或H+、HClO
(4)5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2
【解析】
试题分析:(1)质量相同的O2、NH3、H2、Cl2四种气体中,由V=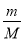 ×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
(2)物质中即与酸反应又与碱反应的主要有:特殊的单质(Al、Zn、Cl2、S、Si 等)、两性化合物(ZnO、AI2O3、Al(OH)3等)、弱酸的酸式盐(NaHS、NaHCO3等)、弱酸的铵盐(NH4)2CO3等)、部分化合物(SO2、NO2等)、氨基酸。
(3)氯水溶液中存在反应:Cl2+H2O?HCl+HClO,是可逆反应,存在电离:H2O H++OH-、HClO
H++OH-、HClO H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
(4)将a mol Cl2 通入含b mol FeBr2的溶液中,还原性Fe2+>Br― ,所以通入氯气,Fe2+ 先被氯气氧化,反应完后再通氯气,Br― 被氧化。所以当0< a / b≤1/2时,只有Fe2+被氧化,所以发生反应2Fe2++Cl2 =2Fe3++2Cl-;当 a / b =1时,Fe2+全部被氧化,Br―是Fe2+的2倍,只有1半被氧化,所以发生的反应方程式为2Cl2+2Fe2++2Br―= 2Fe3++Br2+4Cl―;当a / b≥3/2时,Fe2+、Br―全部被氧化,所以反应为3Cl2+2Fe2++4Br―=2Fe3++2Br2+6Cl― 。标准状况下把11.2L氯气物质的量是0.5mol,500ml0.8mol/LFeBr2物质的量是0.4mol,氯气与FeBr2的物质的量比是5:4,介于1/2和3/2之间,Fe2+全部被氧化,Br―有剩余所以氯气与Fe2+全部反应完,得5Cl2+4Fe2++Br―  Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
考点:考查阿伏伽德罗定律,氯水的性质等。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案