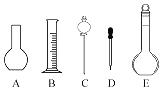
题目内容
【题目】保险粉又称连二亚硫酸钠(Na2S2O4),可用于纺织工业的漂白剂、脱色剂,脱氯剂。Na2S2O4是白色粉末,无味,易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。
Ⅰ.甲酸钠(HCOONa)法制备过程如下:

(1)连二亚硫酸钠中硫元素的化合价为______________。
(2)实验室用Na2SO3 固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。
A.浓盐酸 B.浓硝酸
C.质量分数为70%的硫酸 D.质量分数为10%的硫酸
(3)步骤①中制备连二亚硫酸钠的化学方程式可表示为____________________________。
(4)上述步骤②中,加入适量乙醇水溶液的作用是______________。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_________________________。
(6)①现将0.05mol/L Na2S2O4溶液在空气中放置,其溶液的pH 与时间(t)的关系如图所示。

t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为_______________。
②t1~t2段发生化学反应的离子方程式为______________________________。
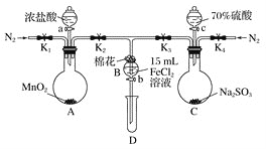
Ⅱ.电解法制备:工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。过程如图所示

(7)①产品在_________________(填“阳极”、“阴极”)得到。
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是__________________________________。
【答案】 +3 C NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O 连二亚硫酸钠难溶于乙醇,用乙醇水溶液可降低连二亚硫酸钠的在溶液中的溶解度,有利于 Na2S2O4晶体析出 Na2CO3为碱性物质, 提高“保险粉”的稳定性 c(HSO3-)>c(SO32-)>c(H2SO3) 2HSO3-+O2=2H++2SO42- 阴极 若不加隔膜,则部分HSO3-到阳极失电子发生氧化反应生成硫酸根离子, 得不到连二亚硫酸钠,使连二亚硫酸钠产率下降或部分HSO3-被阳极产生的 Cl2氧化生成SO42-,使连二亚硫酸钠产率下降
【解析】Ⅰ.(1)连二亚硫酸钠(Na2S2O4)中钠元素为+1价,氧元素为-2价,根据正负化合价的代数和为0 ,硫元素的化合价为+3价,故答案为:+3;
(2)二氧化硫具有还原性,能被硝酸氧化,盐酸中的氯化氢易挥发,制得的二氧化硫不纯,70%的H2SO4产生二氧化硫的速率较快,故选C;
(3)SO2气体通入甲酸钠的碱性溶液可以生成Na2S2O4和二氧化碳,反应的化学方程式为NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O,故答案为:NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O;
(4)根据题意,Na2S2O4易溶于水、难溶于乙醇。加入适量乙醇水溶液可以降低连二亚硫酸钠的在溶液中的溶解度,有利于 Na2S2O4晶体析出,故答案为:连二亚硫酸钠难溶于乙醇,用乙醇水溶液可降低连二亚硫酸钠的在溶液中的溶解度,有利于 Na2S2O4晶体析出;
(5)由信息可知在碱性介质中稳定,则在包装保存“保险粉”时加入少量的Na2CO3固体,目的是Na2CO3为碱性物质,提高“保险粉”的稳定性,故答案为:Na2CO3为碱性物质,提高“保险粉”的稳定性;
(6)①NaHSO3的电离程度大于水解程度,溶液显酸性,含硫元素的粒子浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3),故答案为:c(HSO3-)>c(SO32-)>c(H2SO3);
②Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为2S2O42-+O2+2H2O=4HSO3-,t1点是为0.1mol/L的NaHSO3,根据图像t2时pH=1,说明NaHSO3完全被氧化生成硫酸氢钠,t1~t2段发生化学反应的离子方程式为2HSO3-+O2=2H++2SO42-,故答案为:2HSO3-+O2=2H++2SO42-;
Ⅱ.(7)①用惰性电极电解NaHSO3溶液得到Na2S2O4,反应过程中S元素的化合降低,被还原,应该在阴极上反应得到Na2S2O4,故答案为:阴极;
②若不加隔膜,则部分HSO3-到阳极失电子发生氧化反应,也可能被阳极产生的氯气氧化,结果都会生成硫酸根离子,得不到连二亚硫酸钠,使连二亚硫酸钠产率下降,故答案为:若不加隔膜,则部分HSO3-到阳极失电子发生氧化反应生成硫酸根离子,得不到连二亚硫酸钠,使连二亚硫酸钠产率下降。

【题目】草酸钴(CoOC2O3)用途广泛,一种利用水钴矿[主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、MnO、CaO等]制取CoC2O4·2H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的作用是将__________还原(填离子符号),该步反应的离子方程式为_________。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+ ,氯元素被还原为最低价。该反应的离子方程式为_______________。
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是(用离子方程式表示,写出其中一个即可)_____________。
(4)萃取剂对金属离子的萃取率与pH的关系如右图所示。使用萃取剂适宜的pH=________(填序号)左右。

A.2.0 B.3.0 C.4.0
(5)滤液I“除钙,镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=_____。