题目内容
等质量的CuO和MgO粉末分别溶于相同体积 的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1(忽略溶液体积变化)。则a与b的关系为
的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1(忽略溶液体积变化)。则a与b的关系为
 的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1(忽略溶液体积变化)。则a与b的关系为
的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1(忽略溶液体积变化)。则a与b的关系为| A.a="b" | B.a="2b" |
| C.2a="b" | D.无法确定 |
C
略

练习册系列答案
相关题目
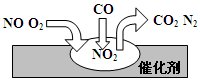
 4CO2+N2
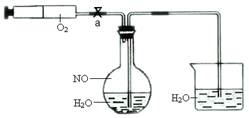
4CO2+N2 程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科
程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
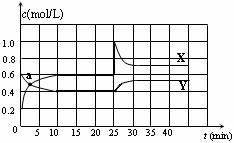
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑, 2NO2(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法不正确的是
2NO2(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法不正确的是