题目内容
【题目】常温下,在10 mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未两出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是( )
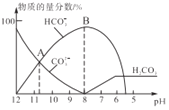
A.Kw(CO32-)的数量级为10-4
B.当溶液是中性时,溶液的总体积大于20 mL
C.在0.1 mol/L Na2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D.在B点所示的溶液中离子浓度最大的是HCO3-
【答案】D
【解析】
A. 根据图象可知当c(HCO3-)=c(CO32-)时,H2CO3的第二步电离平衡常数Ka2=c(H+)>10-11,碳酸根离子水解方程式:CO32-+H2O![]() HCO3-+OH-,当c(HCO3-)=c(CO32-)时,Kw(CO32-)水解平衡常数Kw(CO32-)
HCO3-+OH-,当c(HCO3-)=c(CO32-)时,Kw(CO32-)水解平衡常数Kw(CO32-)![]() ,Kw(CO32-)的数量级为10-4,A正确;
,Kw(CO32-)的数量级为10-4,A正确;
B. 当Na2CO3的物质的量与HCl的物质的量相等时,二者恰好反应产生NaCl和NaHCO3,加入的HCl体积是10 mL,此时溶液总体积为20 mL,NaHCO3是强碱弱酸酸式盐,HCO3-水解程度大于其电离程度,使溶液呈碱性,若要使pH=7,则HCl的物质的量要比Na2CO3的稍微多些,即加入的盐酸体积应大于10 mL,此时溶液的总体积大于20 mL,B正确;
C. 任何电解质溶液中都存在电荷守恒,①c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-);溶液中还存在物料守恒:②c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),将②带入①式,整理可得:2c(H2CO3)+c(HCO3-)+c(H+)=c(OH-),所以c(OH-)>c(H2CO3)+c(HCO3-)+c(H+),C正确;
D. B点溶液中溶质为NaHCO3,钠离子不水解,HCO3-会发生水解反应、电离作用而消耗,水电离产生的H+、OH-的离子浓度很小,所以溶液中浓度最大的阳离子是Na+,D错误;
故合理选项是D。

 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案【题目】一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
【题目】下列关于实验的说法正确的是![]()
实验目的 | 实验方案 | |
A | 除去苯中溶有的苯酚 | 取苯与苯酚的混合液,加入浓溴水,过滤 |
B | 证明 | 将 |
C | 分离 | 将混合液倒入过滤器中过滤 |
D | 酸性: |
|
A.AB.BC.CD.D