题目内容
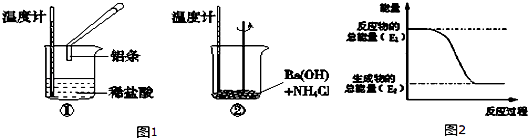
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49kJ/mol.某科学实验在一定温度下,将6molCO2和8molH2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.a,b,c,d括号内数据表示坐标. 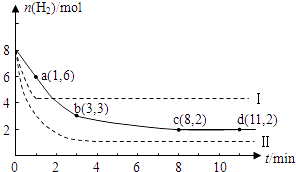
(1)0~a,a~b,b~c,c~d四段中,平均反应速率最大的时间段是 , 该时间段内H2的平均反应速率是 .
(2)a点正反应速率(填大于、等于或小于)逆反应速率.
(3)平衡时CO2的转化率是;反应前、后容器内的压强比是 .
【答案】
(1)0~a;1mol/(L?min)
(2)大于
(3)33.3%;7:5
【解析】解:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,分别计算不同时间内的反应速率:0~1min内,v(H2)= ![]() =1mol/(Lmin);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小, 所以答案是:0~a;1mol/(Lmin);(2)根据图示a点不是平衡状态,反应继续正向进行,所以正反应速率大于逆反应速率,所以答案是:大于;
=1mol/(Lmin);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小, 所以答案是:0~a;1mol/(Lmin);(2)根据图示a点不是平衡状态,反应继续正向进行,所以正反应速率大于逆反应速率,所以答案是:大于;
·(3)
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | ||
起始物质的量/mol | 6 | 88 | 0 | 0 | |
物质的量变化/mol | 2 | 6 | 2 | 2 | |
平衡物质的量/mol | 4 | 2 | 2 | 2 |
二氧化碳的转化率= ![]() ×100%=33.3%,反应前后容器内的压强比等于气体物质的量之比:P前:P后=(6+8):(4+2+2+2)=14:10=7:5;
×100%=33.3%,反应前后容器内的压强比等于气体物质的量之比:P前:P后=(6+8):(4+2+2+2)=14:10=7:5;
所以答案是:33%;7:5.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.