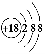题目内容
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1
2XY3(g) ΔH=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热:23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
下列叙述不正确的是( )
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①的体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
B
【解析】平衡常数只与温度有关,温度不变,平衡常数不变,A项正确;由达平衡时①放出的热量为23.15 kJ,可知X2和Y2的转化率均为25%,即平衡时X2、Y2和XY3的物质的量分别为0.75 mol、2.25 mol和0.5 mol,此时XY3的物质的量浓度均为2 mol·L-1,可知②的反应应逆向进行,反应过程需要吸收热量,B项错误;两容器中反应达平衡时为等效平衡,故C项正确;增大压强平衡向正反应方向移动,放出热量多,D项正确。

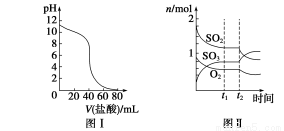
2SO2(g)+O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
| 甲 | 乙 | 丙 | 丁 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0. 40 | 0.80 | 0 |
n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是( )
A.丁中SO3的平衡转化率为α3=80%
B.该温度下,平衡常数的值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率小于乙中O2的转化率
Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图(图1)判断这个分子是极性分子还是非极性分子?____________________。
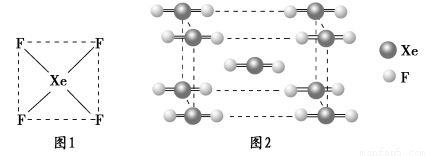
(2)XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?__________________。
Ⅱ.已知有关物质的熔、沸点数据如下表:
物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
熔点/℃ | 2 852 | 2 072 | 714 | 190(2.6×105Pa) |
沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,用电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
___________________________________________________________________________________________________________________________________。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是___________________________________________________________________________________________________________________________________。