题目内容
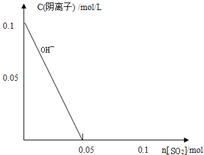
0.1mol/L的NaOH溶液0.2L,通入448mL(标准状况)H2S气体,所得溶液离子浓度大小关系正确的是( )
分析:A、1mol/L的NaOH溶液0.2L,溶质氢氧化钠物质的量为0.02mol,通入448mL(标准状况)H2S气体物质的量为0.02mol,发生反应为NaOH+H2S=NaHS+H2O,依据NaHS溶液中离子浓度大小比较;
B、依据溶液中电荷守恒和物料守恒计算分析判断;
C、依据微粒守恒分析判断;
D、依据溶液中电荷守恒分析判断;
B、依据溶液中电荷守恒和物料守恒计算分析判断;
C、依据微粒守恒分析判断;
D、依据溶液中电荷守恒分析判断;
解答:解:A、1mol/L的NaOH溶液0.2L,溶质氢氧化钠物质的量为0.02mol,通入448mL(标准状况)H2S气体物质的量为0.02mol,发生反应为NaOH+H2S=NaHS+H2O,反应后的溶液为NaHS溶液,溶液中水解大于电离溶液呈碱性,溶液中离子浓度大小为:c(Na+)>c(HS-)>c(OH-)>c(H2S)>c(H+)>c(S2-);故A错误;
B、溶液中存在物料守恒为:c(Na+)=c(H2S)+c(HS-)+c(S2-),溶液中电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),两式合并得到c(S2-)+c(OH-)=c(H+)+c(H2S),故B正确;
C、依据物料守恒分析c(Na+)=c(H2S)+c(HS-)+c(S2-),故C错误;
D、依据溶液中电荷守恒分析得到,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),故D错误;
故选AB.
B、溶液中存在物料守恒为:c(Na+)=c(H2S)+c(HS-)+c(S2-),溶液中电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),两式合并得到c(S2-)+c(OH-)=c(H+)+c(H2S),故B正确;
C、依据物料守恒分析c(Na+)=c(H2S)+c(HS-)+c(S2-),故C错误;
D、依据溶液中电荷守恒分析得到,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),故D错误;
故选AB.
点评:本题考查了电解质溶液中物料守恒,电荷守恒、离子浓度大小比较,掌握基础是关键,题目难度中等.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
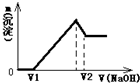 将0.1mol镁、铝合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀与所加NaOH溶液体积的关系如图所示.试回答下列问题:
将0.1mol镁、铝合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀与所加NaOH溶液体积的关系如图所示.试回答下列问题: