题目内容
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.标准状况下,22.4 L氯气通入1 L水中转移的电子数为NA
B.标准状况下,11.2 L SO3所含的原子数为2NA
C.1 mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
D.15.6 g Na2S和Na2O2的混合物中含有的阴离子数等于0.2NA
【答案】D
【解析】
A.标况下22.4L氯气的物质的量为1mol,1mol氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸,反应转移的电子小于1mol,转移的电子数小于NA,故A错误;
B.标准状况下,三氧化硫不是气体,不能使用标况下的气体摩尔体积计算11.2L三氧化硫的物质的量,故B错误;
C.一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故1mol氯化铁形成的氢氧化铁胶粒的个数小于NA个,故C错误;
D.硫化钠和过氧化钠的摩尔质量都是78g/mol,15.6g硫化钠和过氧化钠的混合物的物质的量n=![]() =
=![]() =0.2mol,1mol硫化钠和过氧化钠的混合物中含有1mol硫离子和过氧根离子,0.2mol硫化钠和过氧化钠的混合物中含有0.2mol硫离子和过氧根离子,含有的阴离子数N=nNA=0.2NA,故D正确;
=0.2mol,1mol硫化钠和过氧化钠的混合物中含有1mol硫离子和过氧根离子,0.2mol硫化钠和过氧化钠的混合物中含有0.2mol硫离子和过氧根离子,含有的阴离子数N=nNA=0.2NA,故D正确;
答案选D。

【题目】已知:相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
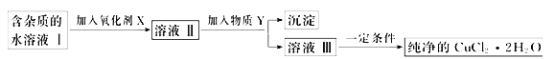
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是______________。
A.K2Cr2O7B.NaClO C.H2O2D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(I2+2S2O32-= S4O62-+2I-)
①可选用___________作滴定指示剂。
②CuCl2溶液与KI反应的离子方程式为________________。
③该试样中CuCl2·2H2O的质量百分数为_______________。