题目内容
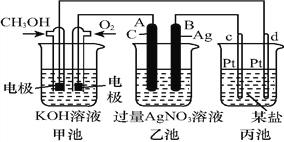
【题目】如图是一个化学过程的示意图:
请回答:
(1)图中甲池是______装置,其中OH-移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH电极的电极反应式:_______________________________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为_____极(填“A”或“B”),
并写出此电极的电极反应式:______________________。
(4)乙池中反应的离子方程式为________________________。
(5)当乙池中B(Ag)极质量增加5.40 g时,乙池c(H+)是_______(若乙池中溶液为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是_________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
【答案】 原电池 CH3OH CH3OH-6e-+8OH- === CO32-+6H2O A 4OH--4e- === O2↑+2H2O 4Ag++2H2O![]() 4Ag+O2↑+4H+ 0.1mol·L-1 BD
4Ag+O2↑+4H+ 0.1mol·L-1 BD
【解析】(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放CH3OH的电极移动;(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH- === CO32-+6H2O;(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上水得电子生成氧气和氢离子,溶液呈酸性,加热紫色石蕊试液呈红色,电极反应式为4OH--4e- === O2↑+2H2O;(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O![]() 4Ag+O2↑+4H+;(5)常温下,当乙池中B(Ag)极质量增加5.40 g,即析出银的物质的量为0.05mol时,生成氢离子的物质的量为0.05mol,而乙池中溶液的体积为500mL,由此可得乙池c(H+)是0.1mol·L-1;根据放电规律,首先排除MgSO4和NaCl;此时丙池某电极析出1.60 g金属铜时,正好转移0.05mol电子,因此CuSO4符合题意。若丙装置中为AgNO3溶液,且AgNO3溶液不足量,金属银全部析出后再电解水,析出银的质量也可能为1.60 g。答案选BD。
4Ag+O2↑+4H+;(5)常温下,当乙池中B(Ag)极质量增加5.40 g,即析出银的物质的量为0.05mol时,生成氢离子的物质的量为0.05mol,而乙池中溶液的体积为500mL,由此可得乙池c(H+)是0.1mol·L-1;根据放电规律,首先排除MgSO4和NaCl;此时丙池某电极析出1.60 g金属铜时,正好转移0.05mol电子,因此CuSO4符合题意。若丙装置中为AgNO3溶液,且AgNO3溶液不足量,金属银全部析出后再电解水,析出银的质量也可能为1.60 g。答案选BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组能探究发现水果汁中存在电解质,可以设计成如图所示的水果原电池。随后又进一步思考原电池工作效率和其构成要素之间的一些关系如下表所示。
实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 西红柿 | 3 | 750 |
4 | 锌 | 铝 | 菠萝 | 3 | 650 |
5 | 锌 | 铝 | 苹果 | 3 | 450 |
6 | 锌 | 铝 | 苹果 | 2 | 550 |
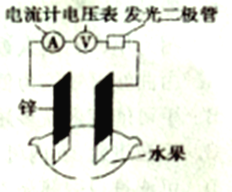
表中数据可知,下列说法不正确的是
A. 实验1、4电流方向应该相反
B. 电极及其间距相同时,电压大小只与水果种类有关,与其他因素无关
C. 如果用锌、碳棒作电极,实验1中电压可能大于900mV
D. 实验中发光二极管不太亮,可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来
【题目】组成生命的最基本元素之一是碳,其单质及化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子价电子原子轨道表示式为________,其核外有________种空间运动状态的电子.
(2) 有机物中都含有碳原子,这和碳原子电子云的成键特点有关,试解释有机物种类繁多的原因________ 。
(3) 比较下列碳酸盐在一定温度下会发生分解的温度和对应的阳离子半径,分析其变化规律及原因_____________。
碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离了半径/pm | 66 | 99 | 112 | 135 |
(4)1828 年,德国化学家乌勒(F·Wohler)冲破了生命力学说的束缚,在实验室里将无机物氰酸铵(NH4CNO)溶液蒸发,得到了有机物尿素[CO(NH2)2]。尿素中C、N、O第一电离能大小顺序为____________。
(5) 碳的同素异形体有多种,其中一种为石墨,系平面层状结构。同一层内每个碳原子与其它三个碳原子以C -C 键相连构成平面正六边形,且层间可以滑动,它的结构如图所示。其中碳原子的杂化方式为_______,层间存在的作用力为__________。
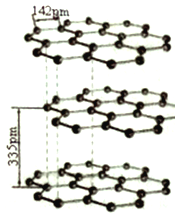
(6)石墨晶体二维结构的特殊性。
①同一层面内的平面六元并环结构(见上图)。在含lmolC原子的石墨中,有_____个平面正六边形。
②已知石墨层间距为335pm,C-C键长为142pm,其密度______g/cm3(已知:lpm=10-10cm。列出计算式即可)