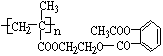题目内容
氧化还原反应是一类重要的化学反应.
(1)据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O
A.该反应中,氧化剂是______,氧化产物是______.
B.参加反应的氧化剂与还原剂的物质的量之比为______(填最简整数比).
(2)金属铜的提炼多从黄铜矿开始,焙烧黄铜矿的反应为:2CuFeS2+O2═Cu2S+2FeS+SO2,已知反应前后Fe元素均为+2价,则CuFeS2中的S为______价,该反应中,被还原的元素为______(填元素符号),若该反应中有1mol O2参与反应,则反应中有______mol电子转移.
(1)据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O
A.该反应中,氧化剂是______,氧化产物是______.
B.参加反应的氧化剂与还原剂的物质的量之比为______(填最简整数比).
(2)金属铜的提炼多从黄铜矿开始,焙烧黄铜矿的反应为:2CuFeS2+O2═Cu2S+2FeS+SO2,已知反应前后Fe元素均为+2价,则CuFeS2中的S为______价,该反应中,被还原的元素为______(填元素符号),若该反应中有1mol O2参与反应,则反应中有______mol电子转移.
(1)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O中,Mn元素化合价由+7价降低到+2价,被还原,为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,Cl2为氧化产物,由方程式可知参加反应的氧化剂与还原剂的物质的量之比为2:10=1:5,
故答案为:KMnO4;Cl2;1:5;
(2)CuFeS2中的S为-2价,反应中2CuFeS2+O2═Cu2S+2FeS+SO2,S元素化合价为-2价部分升高到+4价,反应前后化合价没有发生变化,而Cu元素化合价由+2价降低到+1价,O元素化合价由0价降低到-2价,则被还原的元素为Cu、O,若该反应中有1mol O2参与反应,则反应中有6mol电子转移.
故答案为:-2;Cu、O;6.
故答案为:KMnO4;Cl2;1:5;
(2)CuFeS2中的S为-2价,反应中2CuFeS2+O2═Cu2S+2FeS+SO2,S元素化合价为-2价部分升高到+4价,反应前后化合价没有发生变化,而Cu元素化合价由+2价降低到+1价,O元素化合价由0价降低到-2价,则被还原的元素为Cu、O,若该反应中有1mol O2参与反应,则反应中有6mol电子转移.
故答案为:-2;Cu、O;6.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
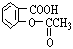 若将阿司匹灵溶于过量的氢氧化钠溶液,其反应的化学方程式为:_________________________
若将阿司匹灵溶于过量的氢氧化钠溶液,其反应的化学方程式为:_________________________