题目内容
【题目】已知:还原性![]() ,氧化性
,氧化性![]() 在含3mol
在含3mol![]() 的溶液中逐滴加入
的溶液中逐滴加入![]() 溶液,加入
溶液,加入![]() 和析出
和析出![]() 的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
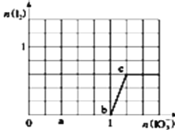
A.b点时的还原产物可能是![]()
B.当![]() 时,溶液中
时,溶液中![]()
C.a点时剩余![]() 的物质的量为
的物质的量为![]()
D.反应过程中的氧化反应所得产物均为![]()
【答案】B
【解析】
还原性![]() ,所以首先是发生以下反应离子方程式:
,所以首先是发生以下反应离子方程式:![]() ,继续加入
,继续加入![]() ,氧化性
,氧化性![]() ,所以
,所以![]() 可以结合H+氧化I-生成I2,离子方程式是
可以结合H+氧化I-生成I2,离子方程式是![]() 。
。
A.![]() 间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:
间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:![]() ,b点时的还原产物是
,b点时的还原产物是![]() ,故A错误;
,故A错误;
B.当![]() 时,0~b间离子方程式为:
时,0~b间离子方程式为:![]() ,b点时的还原产物是
,b点时的还原产物是![]() ,消耗碘酸钾1mol,生成碘离子是1mol,b~c段的离子方程式是
,消耗碘酸钾1mol,生成碘离子是1mol,b~c段的离子方程式是![]() ,当
,当![]() 时,消耗碘离子是0.5mol,溶液中
时,消耗碘离子是0.5mol,溶液中![]() ,故B正确;
,故B正确;
C.a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的![]() ,剩余的是
,剩余的是![]() ,故C错误;
,故C错误;
D.反应过程中的氧化反应所得产物开始时是硫酸根,后期生成硫酸根和碘单质,故D错误;
故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目