题目内容
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
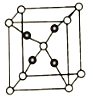
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3
【答案】(1)正四面体型;sp3(2)大于氨气分子间有氢键
(3)![]() PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4
PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4
(4)Cu2++4NH3=[Cu(NH3)4]2+降低溶质的溶解度(5)Cu2O![]()
【解析】
试题分析:A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同,因此A是H。B是同周期元素未成对电子数最多的元素,则B是N;C的最外层电子数为其电子层数的3倍,因此C是O;B与D同族,则D是P;
(1)P的一种单质,难溶于水,较易溶于苯且易自燃,因此是白磷,其立体结构为正四面体型;,D原子的杂化类型为sp3杂化。
(2)A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂,则M是氨气。A和D的单质反应得到化合物N,N还是PH3。由于氨气分子间有氢键,因此氨气的沸点大于PH3。
(3)已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸,红色固体是铜,两种酸是硫酸和磷酸,反应的化学反应方程式为PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4。铜是29号元素,铜的价层电子为3d、4s电子,其价层电子排布图为![]() 。
。
(4)铜离子能与氨气形成配位键,反应的离子反应方程式为Cu2++4NH3=[Cu(NH3)4]2+,加入乙醇的作用是降低溶质的溶解度。
(5)该晶胞中氧原子个数=1+8×1/8=2,铜原子个数为4,该晶胞中氧原子和铜原子个数之比=2:4=1:2,所以化合物的化学式为Cu2O;若两个氧原子间最短距离为apm,设晶胞的边长为x,则![]() ,解得x=
,解得x=![]() ,则
,则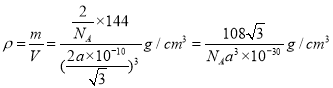 。
。