题目内容
【题目】如图是一个化学过程的示意图。
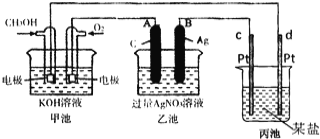
(1)请回答图中甲池是___________装置,其中OH-移向___________极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是___ .
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为___________极(填“A”或“B”),并写出此电极反应的电极反应式____ .
(4)乙池中反应的离子方程式为___ .
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是___________(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是___________(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
【答案】
(1)原电池;负;
(2)CH3OH-6e-+8OH-=CO32-+6H2O;
(3)A;2H2O-4e-=4H++O2↑;
(4)2H2O+4Ag+![]() 4H++O2↑+4Ag;(5)1;BD;
4H++O2↑+4Ag;(5)1;BD;
【解析】
试题分析:(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,故答案为:原电池;负;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上水得电子生成氧气和氢离子,溶液呈酸性,加热紫色石蕊试液呈红色,电极反应式为4H2O-4e-=O2↑+4H+,故答案为:A,4H2O-4e-=O2↑+4H+;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O=4Ag+O2↑+4H+,故答案为:4Ag++2H2O![]() 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
(5)当乙池中B(Ag)极的质量增加2.70g时,设氢离子浓度为xmol/L,
4Ag++2H2O=4Ag+O2↑+4H+;
432g 4mol
2.70g 0.25xmol
x=0.1,则溶液的pH=1,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素,析出2.70g时转移电子是0.025mol。A、硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;B、电解硫酸铜溶液时,阴极上析出0.80g铜需要转移电子0.025mol,故正确;C、氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故错误;D、电解硝酸银溶液时,阴极上析出0.80g银需要转移电子0.0074mol<0.025mol,故正确;故选BD;故答案为:1;BD。

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 碱液 | 过滤 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙醇(水) | 生石灰 | 蒸馏 |
D | 苯(甲苯) | 蒸馏水 | 分液 |
A. A B. B C. C D. D