题目内容
【题目】下列物质在水溶液中的电离方程式错误的是
A. CH3COOH=H+ +CH3COO- B. Ba(OH)2=Ba2++2OH-
C. KHSO4=K++H++SO42- D. MgCl2=Mg2++2Cl-
【答案】A
【解析】
用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式。
A. 醋酸是弱电解质,其电离方程式为CH3COOH![]() H+ +CH3COO-,A错误;
H+ +CH3COO-,A错误;
B. 氢氧化钡是二元强碱,其电离方程式为Ba(OH)2=Ba2++2OH-,B正确;
C. 硫酸氢钾是强酸的酸式盐,其电离方程式为KHSO4=K++H++SO42-,C正确;
D. 氯化镁属于盐类,完全电离,其电离方程式为MgCl2=Mg2++2Cl-,D正确。
答案选A。

【题目】氮氧化物是造成酸雨、臭氧空洞、光化学烟雾等环境问题的主要原因之一。如何消除大气污染物中氮氧化物已成为人们关注的主要问题之一。
I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O2![]() 4N2+6H2O
4N2+6H2O
(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(1) △H =-1891.5kJmol-1
4N2(g)+6H2O(1) △H =-1891.5kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H =+180.5kJmol-1
2NO(g) △H =+180.5kJmol-1
③H2O(1)=H2O(g) △H =+44.0kJmol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为_________________________________。
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。
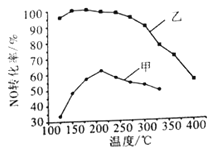
①工业上选择催化剂乙的原因是_________________。
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是_______________________。
Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJmol-1
(3)在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据,计算0-4min内v(NO2)=____________,该温度下的平衡常数K=________________。
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率α(NO2)如下图,则下列叙述正确的是_____________
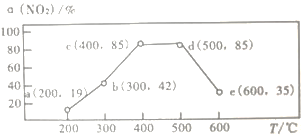
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
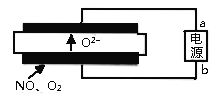
Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
(5)清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)