题目内容
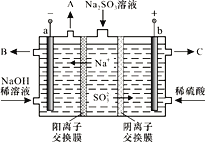
【题目】某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。
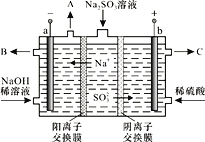
(1)当有1molNa+通过阳离子交换膜时,a极生成气体__________L(标准状况),阳极的电极反应式是______________________________。
(2)稀NaOH溶液的作用是____________,B处流出较浓的NaOH溶液,C处流出的是________________。
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40m3,理论上需要消耗甲烷___________m3。
【答案】 11.2 SO32- -2e-+H2O==SO42- +2H+ 增强溶液导电性 较浓的硫酸 2
【解析】根据装置图中正负极和溶液中离子的移动方向及放电能力,即可判断出两极产物,进而写出电极反应式;由于水中离子浓度很小,所以稀NaOH溶液和稀硫酸的作用都是增强溶液的导电性;根据电子转移守恒,可计算出消耗甲烷的体积。
(1) 当有1mol Na+通过阳离子交换膜时,即电路中通过1mol电子,在阴极放出H2在标准状况下的体积为11.2L;而在阳极上SO32-放电生成SO42-,电极反应式为SO32--2e-+H2O==SO42-+2H+。
(2)由于水中离子浓度很小,所以用稀NaOH溶液和稀硫酸增强溶液的导电性,提高工作效率;根据阳极反应式可知,从C处流出的物质是较浓的硫酸。
(3)处理含SO2 20%(体积分数)的废气40m3,则n(SO2)=[40×103L×20%]/22.4L/mol= 8000/22.4mol,则转移电子n(e-)=8000/11.2mol,而1molCH4在燃料电池中反应生成1mol CO2转移8mol电子,所以理论上需要消耗甲烷的体积为![]() ×10-3m3/L =2 m3。
×10-3m3/L =2 m3。

【题目】对处于元素周期表中下列位置的①~⑩十种元素,根据有关要求回答:
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)能形成共价键的元素共有____种。
(2)只需形成一个共价单键就能达到稳定结构的元素有_______ (填元素符号)。
(3) 彼此间形成共价化合物数量最多的两种元素分别是____(填元素符号)。
(4)写出⑩的最低正价含氧酸电子式________;
写出含氧量最高的离子化合物与共价化合物的电子式__________、___________
(5)写出 ①⑤⑦⑨形成的化合物熔融状态下的电离方程式:_____________________
写出该化合物与⑧的最高价氧化物反应的离子方程式______________________
(6)气态氢化物溶于水呈碱性的元素是____(填元素名称),写出其气态氢化物与其最高价氧化物对应的水化物反应的离子方程式:_____________________________
(7)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为__,它与③形成的化合物的化学式为___,含有的化学键类型是____。