题目内容
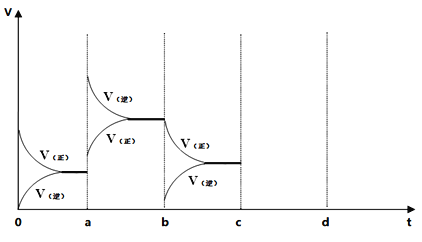
【题目】用纯净的 CaCO3 与 l00mL 稀盐酸反应制取 CO2,实验过程记录如图所示(CO2 的体积己折算为标准状况下的体积)。下列分析正确的是( )
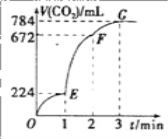
A.EF 段,用盐酸表示该反应的平均反应速率为 0.4 mol·(L·min) -1
B.OE 段表示的平均速率最快
C.F 点收集到的 CO2 的量最多
D.OE、EF、FG 三段中,该反应用二氧化碳表示的平均反应速率之比为 2∶6∶7
【答案】A
【解析】
A.EF段产生的CO2共0.02 mol,由于反应中n(HCl)∶n(CO2)=2∶1,所以该段消耗n(HCl)=0.04 mol,时间1 min,所以用盐酸表示的EF段平均化学速率是0.4 mol·L-1·min-1,A正确;
B.单位时间内反应生成的多或反应物消耗的多,则速率快。由于横坐标都是1个单位,EF段产生的CO2多,所以该段反应速率最快,不是OE段,B错误;
C.收集的CO2是看总量的,F点只有672 mL,应该是G点的体积最多,C错误;
D.由于时间都是1 min,所以三段的速率之比就等于产生CO2的体积之比,即224∶(672-224)∶(784-672)=2∶4∶1,D错误;故答案为A。

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目