题目内容
【题目】微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好根据上述描述涉及到的元素,回答下列问题:
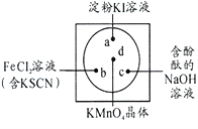
(1)a中反应的化学反应方程式为________________________________________证明KI中含有钾元素的方法是:____________________________。
(2)c中反应的离子反应方程式为_______________________________________b中的现象是________________________________________________。
(3)短周期原子半径最大的原子共有______种不同能量的电子。它与同周期原子半径最小元素形成晶体,该晶体中每个阳离子周围距离最近有_______个阴离子。
(4)把少许 KMnO4撒入盛水烧杯中溶解,包含物理过程(即__________过程和化学过程(即_____________过程。所以,溶液中的有色离子应该是__________________(写名称)
(5)NH3与H2O分别能与H+结合成NH4+与H3O+。与NH4+具有相同空间构型的微粒是_______;
a.H3O+b.CH4c.P4d.NH3
(6)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与 Cl2反应制KIO3,至少需要消耗Cl2___________________L(标准状况,保留2位小数)
【答案】2KI+ Cl2→2KCl +I2 焰色反应Cl2+2OH-→ Cl-+ Cl O-+H2O溶液变为红色46扩散水合水合高锰酸根离子BC10.58
【解析】
(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,所以发生的反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,氯气与碘化钾发生:2KI+Cl2=2KCl+I2,单质碘遇淀粉变蓝,无色碘化钾溶液逐渐变成蓝色;检验钾离子要通过焰色反应,通过钴玻璃观察焰色反应呈紫色证明含钾离子;故答案为:2KI+Cl2=2KCl+I2;焰色反应;
(2)在碱性条件下自身发生氧化还原反应:2OH-+Cl2=Cl-+ClO-+H2O,氢氧化钠浓度逐渐减小,酚酞溶液的红色逐渐褪去;氯气与Fe2+发生:2Fe2++Cl2=2Fe3++2Cl-,铁离子遇硫氰化钾变红,故答案为:2OH-+Cl2=Cl-+ClO-+H2O;溶液变为红色;
(3)短周期原子半径最大的原子为钠元素,电子排布式为:1s22s22p63s1,1s、2s、2p、3s能级上电子能量各不相同,故有4种不同能量的电子;第3周期原子半径最小的为氯元素,钠和氯形成的为离子晶体,每个钠离子周围距离最近的氯离子有6个(同一面上4个,上下各1个),故答案为:4;6;
(4)把少许KMnO4撒入盛水烧杯中溶解,包含物理过程即扩散过程,化学过程即形成水合离子的过程,水合钾离子无色,故有色离子为水合高锰酸根离子;
故答案为:扩散;水合;水合高锰酸根离子;
(5)NH4+的空间结构为正四面体;H3O+、CH4、P4、NH3的空间结构为三角锥形、正四面体、正四面题、三角锥形,所以微粒与NH4+具有相同空间构型的微粒是CH4、P4,故选:b、c;
(6)1000kg加碘食盐中含碘20g,KI+3Cl2+3H2O=KIO3+6HCl,根据KIO3~I~KI~3Cl2可知,则需要消耗标准状况下Cl2的体积为:![]() ×3×22.4L/mol=10.58L。故答案为10.58。
×3×22.4L/mol=10.58L。故答案为10.58。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案