题目内容
将11.9g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g。另取等质量的合金溶于过量稀硝酸中,生成了6.72LNO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
| A.22.1g | B.27.2g | C.30g | D.30.2g |
B
解析试题分析:将合金加入热氢氧化钠溶液中,铝发生反应,减少的质量就是铝的质量,n(Al)=m∕M=2.7g∕27g.mol-1=0.1mol。m(氢氧化铝)=n(氢氧化铝)×M=0.1mol×78g∕mol=7.8g。n(NO)总=0.3mol.根据方程式Al+4HNO3=Al(NO3)3+NO↑+2H2O可知铝放出NO气体0.1mol.镁和铝放出的一氧化氮为0.3-0.1=0.2mol.镁和铝质量和为11.9-2.7=9.2g,根据3Mg+8HNO3=3Mg(NO3)2+2NO↑+4H2OFe+4HNO3=Fe(NO3)3+NO↑+2H2O就可以求出各自的质量,进而求出它们转化得到的沉淀的质量。求解得n(Mg)=0.15mol,n(Fe)=0.1mol.Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量=0.15mol×58g∕mol+0.1mol×78g∕mol+0.1mol×107g∕mol=27.2g选项为:B。
考点:考查Mg、Al、Fe等金属与足量的酸、碱反应的计算的相关知识。

练习册系列答案
相关题目
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A.标准状况下,NA个NO分子和0.5 NA个O2分子混合后气体的总体积为33.6 L |
| B.10g D2O晶体中含有的氢氧键数目为NA |
| C.标准状况下,1 mol SO3分子体积约为22.4 L |
| D.常温常压下,1 mol氦气含有的核外电子数为4 NA |
下列有关化学用语表示正确的是
| A.甲苯的结构简式:C7H8 |
B.水合氢离子电子式: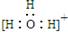 |
C.氟离子的结构示意图: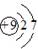 |
D.中子数为18的硫原子 S S |
同温同压下,等质量的O2和O3相比较,下列结论正确的是( )
| A.它们的分子数目之比是 1∶1 | B.它们的氧原子数目之比为 2∶3 |
| C.它们的密度之比为 2∶3 | D.它们的体积之比是 1∶1 |
下列叙述正确的是 ( )
| A.1 mol H2O的质量为18g/mol |
| B.CH4的摩尔质量为16g |
| C.3.01×1023个SO2分子的质量为32g |
| D.标准状况下,1 mol任何物质体积均为22.4L |
下列化学用语表示正确的是
A.Cl-离子的结构示意图: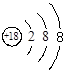 |
B.Ca(OH)2的电离方程式:Ca(OH)2 Ca2++2OH- Ca2++2OH- |
| C.稀盐酸中投入铁钉:2Fe+6HCl=2FeCl3+3H2↑ |
D.中子数为18的氯原子: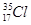 |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.0.1 mol Cl2完全溶于水,转移的电子数目为0.1NA |
| B.足量的硫单质与64g铜完全反应,转移电子数目为NA |
| C.1 mol Fe与足量的稀HNO3反应,转移2NA个电子 |
| D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1 |
下列化学用语正确的是( )
| A.乙烯的比例模型: |
| B.HClO的结构式:HClO |
C.H2O2的电子式: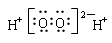 |
| D.乙醇的分子式:CH3CH2OH |