题目内容
15.等物质的量的①Na②Na2O③Na2O2④NaOH,分别与足量水作用后并稀释成相同体积,所得溶液物质的量浓度的说法正确的是,( )| A. | ①②③④都不相等 | B. | ①④和②③分别相等 | C. | ②③相等,①④不等 | D. | ①④相等,②③不等 |
分析 等物质的量的①Na②Na2O③Na2O2④NaOH,根据Na原子守恒得,n(NaOH)大小顺序是②=③>①=④,溶液体积相等,根据c=$\frac{n}{V}$判断溶液物质的量浓度相对大小.
解答 解:等物质的量的①Na②Na2O③Na2O2④NaOH,根据Na原子守恒得,n(NaOH)大小顺序是②=③>①=④,溶液体积相等,根据c=$\frac{n}{V}$知,溶液物质的量浓度大小顺序是②=③>①=④,故选B.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,正确判断氢氧化钠物质的量是解本题关键,注意原子守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
6.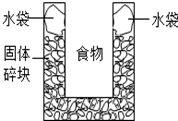 如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )
如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )
 如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )
如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )| A. | 硝酸铵 | B. | 食盐 | C. | 蔗糖 | D. | 生石灰 |
3.下列热化学方程式正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为 H2(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;\;120℃\;\;\;}}{101KPa}$H2O(g)△H=-242 kJ/mol | |
| D. | 25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ/mol |
10.下列各项性质的比较中正确的是( )
| A. | 稳定性:H2O<H2S<HBr<HCl | B. | 氧化性:Cu2+>H+>Fe3+>Na+ | ||
| C. | 酸性:HClO4>H2SO4>H2PO4>H3AsO4 | D. | 半径:K+>Cl->Al3+>Mg2+ |
4.分子式为C10H12O2的有机物,其苯环上只有两个取代基,且能与NaHCO3,溶液反应产生气体的结构(不是立体异构)有( )
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
 K增大的有A(填字母)
K增大的有A(填字母)