题目内容
下列叙述正确的是( )
| A、稀有气体原子序数越大,熔点越低 |
| B、同周期元素的原子半径越小,气态氢化物还原性越弱 |
| C、晶体中分子间作用力越强,分子越稳定 |
| D、卤族元素的氢化物,相对分子质量越大,熔沸点越高 |
考点:晶体的类型与物质熔点、硬度、导电性等的关系
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A.0族元素的单质属于分子晶体,对应元素的原子序数越大,气体的相对分子质量越大,沸点逐渐增大;
B.同周期元素从左到右原子半径逐渐减小,元素的非金属性逐渐增强,金气态氢化物还原性逐渐减弱;
C.分子间作用力与稳定性无关;
D.元素气态氢化物的沸点一般随相对分子质量增大而增大,但含有氢键的物质的沸点较高;
B.同周期元素从左到右原子半径逐渐减小,元素的非金属性逐渐增强,金气态氢化物还原性逐渐减弱;
C.分子间作用力与稳定性无关;
D.元素气态氢化物的沸点一般随相对分子质量增大而增大,但含有氢键的物质的沸点较高;
解答:
解:A.稀有气体的单质属于分子晶体,原子序数越大,熔点越高,故A错误;
B.同周期元素的原子半径越小,元素的非金属性逐渐增强,气态氢化物还原性越弱,故B正确;
C.分子的稳定性属于化学性质,与共价键有关,分子间作用力与稳定性无关,故C错误;
D.气态氢化物中HF中含氢键,沸点最高,而HCl、HBr、HI的相对分子质量在增大,气态氢化物的沸点升高,故D错误;
故选B.
B.同周期元素的原子半径越小,元素的非金属性逐渐增强,气态氢化物还原性越弱,故B正确;
C.分子的稳定性属于化学性质,与共价键有关,分子间作用力与稳定性无关,故C错误;
D.气态氢化物中HF中含氢键,沸点最高,而HCl、HBr、HI的相对分子质量在增大,气态氢化物的沸点升高,故D错误;
故选B.
点评:本题考查晶体的组成和性质,题目难度不大,本题注意相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图所示,电极A、B为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.下列有关该生产过程的叙述不正确的是( )
某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图所示,电极A、B为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.下列有关该生产过程的叙述不正确的是( )| A、该原电池的A为正极,B为负极 |
| B、B极的电极反应式为SO2+2H2O-2e-═SO42-+4H+ |
| C、溶液中H+的移动方向由A极到B极 |
| D、电池总反应式为2SO2+O2+2H2O═2H2SO4 |
下列仪器对应名称错误的是( )
A、 烧杯 |
B、 量筒 |
C、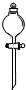 分液漏斗 |
D、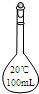 烧瓶 |
下列关于有机物的叙述正确的是( )
| A、汽油、柴油和植物油的成分都是碳氢化合物 |
| B、棉花和合成纤维的主要成分均为纤维素 |
| C、乙烯和苯蒸气都能使溴水褪色,不能鉴别乙烯和苯蒸气 |
| D、甲烷跟氯气在光照条件下的反应与乙酸、乙醇和浓硫酸共热时的反应类型相同 |
元素X、Y、Z原子序数之和为33,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )
| A、在短周期元素中X的金属性最强 |
| B、Y的最高价含氧酸属于弱酸 |
| C、原子半径Z>Y,离子半径Z2->X+ |
| D、Y、Z都可与氢元素形成氢化物,Z的氢化物比Y的氢化物稳定 |
下列选项中的离子方程式书写正确的是( )
| A、稀硫酸和Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O |
| C、铜在加热条件下与浓硫酸反应:Cu+SO42-+4H+═Cu2++SO2↑+2H2O |
| D、SO2使溴水褪色:SO2+Br2+2H2O═SO42-+2Br-+4H+ |
将如图所示实验装置的K闭合,下列判断正确的是( )
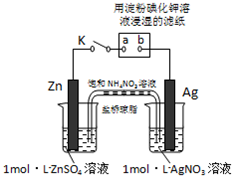

| A、Ag电极上发生氧化反应 |
| B、盐桥中NO3-向Zn电极移动 |
| C、电子沿Zn→a→b→Ag路径流动 |
| D、片刻后可观察到滤纸a点变蓝 |
将质量为w1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1 L.向溶液中逐渐加入浓度为a mol/L的HCl溶液,反应过程中先有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2 L.将溶液蒸干灼烧得固体w2 g.下列关系式中正确的是( )
A、n(Na)+3n(Al)=
| ||
B、aV2=
| ||
| C、35.5aV2=w2-w1 | ||
| D、35.5aV2>(w2-w1) |
下列叙述正确的是( )
| A、同种元素的原子均具有相同的质子数和中子数 |
| B、不同元素的原子构成的分子只含极性键 |
| C、第三周期中的非金属元素的气态氢化物还原越强,对应元素的最高价含氧酸酸性越弱 |
| D、第ⅦA族元素从上到下单质及对应的气态氢化物的沸点均逐渐升高 |