题目内容
【题目】TMB由碳氢氮三种元素组成,其相对分子质量为240,是一种新型指纹检测的色原试剂,已在逐步取代强致癌物联苯胺和其他致癌性的联苯胺衍生物应用于临床化验法医检验刑事侦破及环境监测等领域。某研究小组欲利用燃烧法测定TMB的分子式(氮元素转化为N2)实验装置如图所示。回答下列问题:
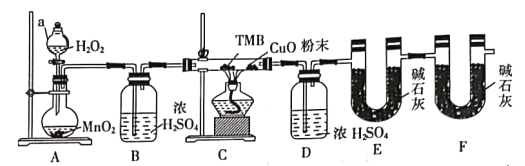
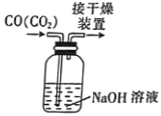
(1)实验装置两处用到装有碱石灰的干燥管,其中F处的目的是______________________。仪器a的名称是___________。
(2)将足量双氧水置于a中,圆底烧瓶中装入MnO2固体,按图连接好装置。
①A中发生反应的化学方程式为______________________。
②待B、D处导管口有均匀气泡时,再点燃C处酒精灯,原因是______________________。
(3)装置C中CuO粉末的作用为_________________________________。
(4)该实验___________(填“需要”或“不需要”)尾气处理,其原因是____________________。
(5)理想状态下,将4.80gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60g,E增加14.08g,则TMB的分子式为___________。
【答案】防止外界空气中的CO2和H2O进入E中,避免对E处吸收CO2的定量检测造成干扰; 分液漏斗 2H2O2![]() 2H2O+O2↑ 排除装置内原有的CO2和水蒸气 使TMB不充分燃烧生成CO全部转化为CO2 不需要 碳元素必须燃烧完全才能保证实验结果的准确性,无有毒气体排放 C16H20N2
2H2O+O2↑ 排除装置内原有的CO2和水蒸气 使TMB不充分燃烧生成CO全部转化为CO2 不需要 碳元素必须燃烧完全才能保证实验结果的准确性,无有毒气体排放 C16H20N2
【解析】
(1)利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳进入E装置中,影响测量结果;根据仪器的结构判断写出名称;
(2)①双氧水在二氧化锰催化下分解生成水和氧气;
②氧气排除装置内原有的CO2和水蒸气;
(3) CO与CuO发生氧化还原反应生成铜和CO2;
(4)因碳元素完全转化为二氧化碳,且生成氮气,没有必要进行尾气处理;
(5)实验结束时测得D增加3.60g,E增加14.08g,则燃烧生成的m(H2O)=3.60g、m(CO2)=14.08g,则n(H2O)=![]() =0.2mol,n(H)=0.4mol,n(CO2)=
=0.2mol,n(H)=0.4mol,n(CO2)=![]() =0.32mol,n(C)=0.32mol,所以m(N)=4.80g-0.32mol×12g/mol-0.4mol×1g/mol=0.56g,n(N)=
=0.32mol,n(C)=0.32mol,所以m(N)=4.80g-0.32mol×12g/mol-0.4mol×1g/mol=0.56g,n(N)=![]() =0.04mol,则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,依据相对分子质量计算分子式。
=0.04mol,则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,依据相对分子质量计算分子式。
(1)利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳进入E装置中,影响测量结果;
根据仪器的结构可知,通过仪器a加入液体反应物并控制加入的量,故仪器a的名称是分液漏斗;
(2)①A中双氧水在二氧化锰催化下分解生成水和氧气,发生反应的化学方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
②待B、D处导管口有均匀气泡时,得到纯净的干燥的氧气进入装置C中,氧气排除装置内原有的CO2和水蒸气后,再点燃C处酒精灯;
(3)装置C中CuO粉末的作用为使TMB不充分燃烧生成CO全部转化为CO2;
(4)碳元素必须燃烧完全才能保证实验结果的准确性,无有毒气体排放,故该实验不需要尾气处理;
(5)实验结束时测得D增加3.60g,E增加14.08g,则燃烧生成的m(H2O)=3.60g、m(CO2)=14.08g,则n(H2O)=![]() =0.2mol,n(H)=0.4mol,n(CO2)=
=0.2mol,n(H)=0.4mol,n(CO2)=![]() =0.32mol,n(C)=0.32mol,所以m(N)=4.80g-0.32mol×12g/mol-0.4mol×1g/mol=0.56g,n(N)=
=0.32mol,n(C)=0.32mol,所以m(N)=4.80g-0.32mol×12g/mol-0.4mol×1g/mol=0.56g,n(N)=![]() =0.04mol,则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,TMB的相对分子质量为240,设分子式为:C8nH10nNn,则有:12×8n+10n+14n=240,解得n=2,所以分子式为C16H20N2。
=0.04mol,则:n(C):n(H):n(N)=0.32mol:0.4mol:0.04mol=8:10:1,TMB的相对分子质量为240,设分子式为:C8nH10nNn,则有:12×8n+10n+14n=240,解得n=2,所以分子式为C16H20N2。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案