题目内容
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示(第一次平衡时c(I-)=2×10-3mol·L-1,c(Pb2+)=1×10-3mol·L-1),下列说法不正确的是

A.常温下,PbI2的Ksp=4×10-9
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度减小,Pb2+浓度不变
C.T时刻可能向溶液中加入了KI固体,Ksp不变
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
【答案】B
【解析】
A. 常温下,PbI2的Ksp=c(Pb2+)×c2(I-) = 1×103×(2×103)2 = 4×109,故A正确;
B. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,c(Pb2+)增大,溶解平衡逆向移动,因此PbI2的溶解度减小,Pb2+浓度增大,故B错误;
C. T时刻,c(I-)突然增大,c(Pb2+)瞬间不变、后减小,可能向溶液中加入了KI固体,Ksp不变,故C正确;
D. 常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数
PbS(s)+2I-(aq)反应的化学平衡常数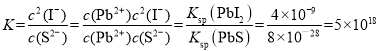 ,故D正确;
,故D正确;
综上所述,答案为B。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案【题目】表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | 1.8×10-10 | 2.0×10-12 | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式H2O+CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COO-):c(CH3COOH)=9:5,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3,CrO42-先沉淀