题目内容
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
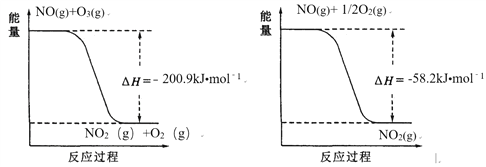
Si(s)+4HCl(g)= SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是____________________________。
(2)工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________。
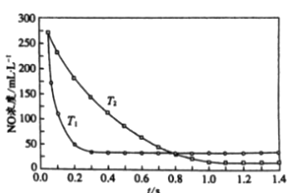
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g) ![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
①353.15K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________。
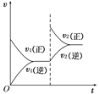
③比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正=![]() ,v逆=
,v逆=![]() ,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时
,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时![]() =________(保留3位小数)。
=________(保留3位小数)。
【答案】Si(s)+3HCl(g)=SiHCl3(g)+H2(g) H=-210kJ/mol SiCl4+LiAlH4=SiH4+LiCl+AlCl3 24% 0.025 吸热 改进催化剂 增大压强或提高反应物浓度 > 0.025
【解析】
(1)由盖斯定律,①-②得硅粉和氯化氢气体生产SiHCl3的热化学方程式:Si(s)+3HCl(g)=SiHCl3(g)+H2(g) H=-210kJ/mol;
(2)题目信息:四氯化硅和氢化铝锂(LiAlH4)反应后得甲硅烷及两种盐,氢化铝锂中有两种金属元素,刚好成两种盐LiCl、AlCl3 ,方程式为:SiCl4+LiAlH4=SiH4+LiCl+AlCl3;
(3)①由图可知353.15K时,最大转化率24%,则平衡转化率为24%;
反应的平衡常数计算:设起始SiHCl3浓度为1mol/L,根据三段式找到达到平衡各物质浓度,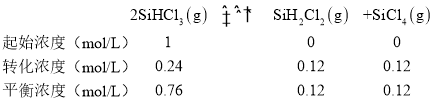
![]() ;
;
由图可知:温度升高,该平衡转化率增大,升温平衡正向移动,则正向是吸热反应。
②323.15K时,要缩短反应达到平衡的时间即加快反应速率,可采取的措施有改进催化剂、增大压强或提高反应物浓度;
③a、b两处转化率相同,说明消耗的SiHCl3等量的,但a的时间比b的短,a的反应速率快,故va>vb;
已知反应速率v正=![]() ,v逆=
,v逆=![]() ,达到平衡时v正=v逆,即
,达到平衡时v正=v逆,即![]() =
=![]() ,变形得
,变形得![]() =
=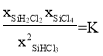 ,由图可知353.15K时,平衡转化率为24%,则在353.15K时
,由图可知353.15K时,平衡转化率为24%,则在353.15K时![]() =K=0.025。
=K=0.025。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是__。
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__。
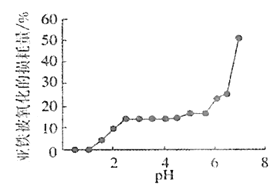
(4)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为__。(写出一条即可)
(5)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:
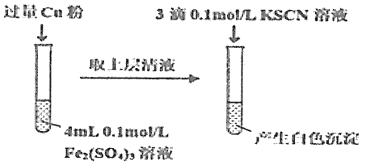
①Fe3+与Cu反应的离子方程式为__。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
ii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
实验方案 | 现象 |
步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 无明显现象 |
步骤2:取4mL_mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 产生白色沉淀 |
Cu2+与SCN-反应的离子方程式为__。