题目内容
(2010?石景山区一模)某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠.设计装置如下:(忽略装置中空气的影响)
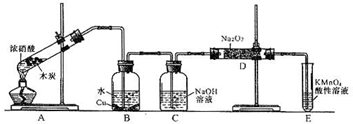
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是
(2)猜测B中可以观察的主要现象是
(3)已知:①室温下存在反应3HNO2=HNO3+2NO↑+H2;②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成.写出检验D中产物是亚硝酸钠的方法:
(4)E装置的作用是
(5)同学们经过讨论认为上述装置仍有缺陷,为避免D管中生成NaOH,你认为应该进行的改进是

请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O.
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O.
.
| ||
(2)猜测B中可以观察的主要现象是
溶液逐渐变蓝
溶液逐渐变蓝
.C瓶出来的气体是NO
NO
.(3)已知:①室温下存在反应3HNO2=HNO3+2NO↑+H2;②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成.写出检验D中产物是亚硝酸钠的方法:
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠
.方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠
(4)E装置的作用是
吸收D中未反应完的NO,以免污染空气
吸收D中未反应完的NO,以免污染空气
.(5)同学们经过讨论认为上述装置仍有缺陷,为避免D管中生成NaOH,你认为应该进行的改进是
在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
.分析:(1)A装置为C与HNO3(浓)反应;
(2)A中产生的NO2,进入B中与水反应生成硝酸,硝酸再溶解铜;即使有未反应完全的NO2,被C中NaOH吸收;
(3)根据题目给的信息可知:①常温下HNO2不稳定;②在酸性溶液中,NO2-可将MnO4-还原为Mn2+,使溶液紫色褪去.据此设计;
(4)有毒气体,不能直接排放到空气中;
(5)过氧化钠与水反应,进入D管气体应干燥.
(2)A中产生的NO2,进入B中与水反应生成硝酸,硝酸再溶解铜;即使有未反应完全的NO2,被C中NaOH吸收;
(3)根据题目给的信息可知:①常温下HNO2不稳定;②在酸性溶液中,NO2-可将MnO4-还原为Mn2+,使溶液紫色褪去.据此设计;
(4)有毒气体,不能直接排放到空气中;
(5)过氧化钠与水反应,进入D管气体应干燥.
解答:解:(1)A装置为C与HNO3(浓)反应制取NO2,反应方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O.
故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
(2)A中产生的NO2,进入B中与水反应生成硝酸,硝酸再与铜反应,方程式为 3Cu+8HNO3(稀)=3Cu(HO3)2+2NO↑+
4H2O,所以,溶液逐渐变蓝.即使有未反应完全的NO2,被C中NaOH吸收,从C中出来的气体为NO.
故答案为:溶液逐渐变蓝;NO
(3)根据题目给的信息可知:①常温下HNO2不稳定;②在酸性溶液中,NO2-可将MnO4-还原为Mn2+,使溶液紫色褪去,据此设计方案.
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.反应的离子方程式是3NO2-+2H+=NO3-+2NO↑+H2O
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,反应的离方程式是5 NO2-+2MnO4-+6H+=5 NO3-+2Mn2++3H2o
故答案为:
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠;
(4)D中可能有未反应完全的NO,NO有毒气体,不能直接排放到空气中,通过E装置吸收,以免污染空气.
故答案为:吸收D中未反应完的NO,以免污染空气
(5)过氧化钠与水反应生成NaOH,进入D管气体应干燥,故应在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
故答案为:在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
| ||
故答案为:C+4HNO3(浓)
| ||
(2)A中产生的NO2,进入B中与水反应生成硝酸,硝酸再与铜反应,方程式为 3Cu+8HNO3(稀)=3Cu(HO3)2+2NO↑+
4H2O,所以,溶液逐渐变蓝.即使有未反应完全的NO2,被C中NaOH吸收,从C中出来的气体为NO.
故答案为:溶液逐渐变蓝;NO
(3)根据题目给的信息可知:①常温下HNO2不稳定;②在酸性溶液中,NO2-可将MnO4-还原为Mn2+,使溶液紫色褪去,据此设计方案.
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.反应的离子方程式是3NO2-+2H+=NO3-+2NO↑+H2O
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,反应的离方程式是5 NO2-+2MnO4-+6H+=5 NO3-+2Mn2++3H2o
故答案为:
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠;
(4)D中可能有未反应完全的NO,NO有毒气体,不能直接排放到空气中,通过E装置吸收,以免污染空气.
故答案为:吸收D中未反应完的NO,以免污染空气
(5)过氧化钠与水反应生成NaOH,进入D管气体应干燥,故应在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
故答案为:在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
点评:本题为综合探究实验题,首先要明确该实验的目的,然后围绕该实验目的,分析题给实验装置中可能涉及的反应原理及装置作用,最后紧扣题意回答有关的问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
 H++HO2-
H++HO2-