��Ŀ����
��8�֣��й���ѧԺ����Ӧ�û�ѧ�о����ڼ״�ȼ�ϵ�ؼ�����������ͻ�ƣ��״�ȼ�ϵ�صĹ���ԭ����ͼ��ʾ��
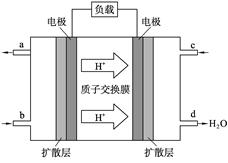
��1����д��c��ͨ������ʷ�������Ӧ�缫��Ӧʽ ��
��2������һ��ʱ���0.2 mol�״���ȫ��Ӧ����CO2ʱ���� NA������ת�ơ�
��3���������������Դ������ͼ��ʾװ�ã���ʵ������ģ������Ʒ���桰�ۻ��������Ĺ����У�����Al�缫��������Dz��������ݳ���ԭ���ǣ�����صĵ缫��Ӧʽ��ʾ����
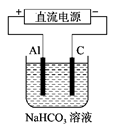
�� ��Al3++3HCO3- =Al(OH)3��+3CO2��

��1����д��c��ͨ������ʷ�������Ӧ�缫��Ӧʽ ��
��2������һ��ʱ���0.2 mol�״���ȫ��Ӧ����CO2ʱ���� NA������ת�ơ�
��3���������������Դ������ͼ��ʾװ�ã���ʵ������ģ������Ʒ���桰�ۻ��������Ĺ����У�����Al�缫��������Dz��������ݳ���ԭ���ǣ�����صĵ缫��Ӧʽ��ʾ����

�� ��Al3++3HCO3- =Al(OH)3��+3CO2��
��1��O2+4e-+4H+=2H2O ��3�֣� ��2�� 1.2��3�֣�
��3����Al-3e-=Al3+��2�֣�
��3����Al-3e-=Al3+��2�֣�
��1��ԭ������������������ƶ������Ը��������ӵ��ƶ������֪��c��������ͨ��������������Ե缫��ӦʽΪO2+4e-+4H+=2H2O ��
��2���״�̼ԭ�ӵĻ��ϼ��ǣ�2�ۣ�����1mol�״�ʧȥ��4��2��mol����˵�0.2 mol�״���ȫ��Ӧ����CO2ʱ����1.2NA������ת�ơ�
��3����Ϊ���͵�Դ��������������������ʧȥ���ӣ����������ӣ���ӦʽΪAl-3e-=Al3+�������Ӻ�̼�����Ʒ�Ӧ������������������CO2���塣
��2���״�̼ԭ�ӵĻ��ϼ��ǣ�2�ۣ�����1mol�״�ʧȥ��4��2��mol����˵�0.2 mol�״���ȫ��Ӧ����CO2ʱ����1.2NA������ת�ơ�
��3����Ϊ���͵�Դ��������������������ʧȥ���ӣ����������ӣ���ӦʽΪAl-3e-=Al3+�������Ӻ�̼�����Ʒ�Ӧ������������������CO2���塣

��ϰ��ϵ�д�
 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
�����Ŀ