题目内容
1.在元素周期表中,同一主族元素化学性质相似.目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族的元素性质相似,称为“对角线”规则.如锂和镁,铍和铝,据此回答:(1)锂在空气中燃烧,除生成Li2O外,也生成微量的Li3N(用化学式作答).
(2)铍的最高价氧化物对应的水化物的化学式是Be(OH)2,它属于两性氢氧化物,可以证明这一结论的离子反应方程式是Be(OH)2+2H+═Be2++2H2O;Be(OH)2+2OH-═BeO22-+2H2O.
(3)已知反应 Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇水反应的化学反应方程式为Al4C3+12H2O═4Al(OH)3↓+3CH4↑.
分析 (1)Mg和Li位于对角线位置,性质相似,结合Mg的性质解答;
(2)Be的化合价是+2,铍的最高价氧化物对应的水化物的化学式为Be(OH)2,根据两性氢氧化物既能与酸反应生成盐和水,又能和碱(强碱)反应生成盐和水的,结合氢氧化铝的性质解答;
(3)根据化合价可知,Al4C3水解生成氢氧化铝与甲烷,以此来解答.
解答 解:(1)Mg能与空气中的氧气、氮气、二氧化碳反应,类比迁移,则锂在空气中燃烧的产物有Li2O和Li3N,Li2O为主要产物,
故答案为:Li2O;Li3N;
(2)Be的化合价是+2,铍的最高价氧化物对应的水化物的化学式为Be(OH)2,根据两性氢氧化物既能与酸反应生成盐和水,又能和碱(强碱)反应生成盐和水.Be(OH)2代表碱时为二元碱,Be(OH)2代表酸时为二元酸,表示碱时:Be(OH)2+2H+═Be2++2H2O,表示酸时:Be(OH)2+2OH-═BeO22-+2H2O,
故答案为:Be(OH)2;Be(OH)2+2H+═Be2++2H2O;Be(OH)2+2OH-═BeO22-+2H2O;
(3)根据化合价可知,Al4C3水解生成氢氧化铝与甲烷,反应的为Al4C3+12H2O═4Al(OH)3↓+3CH4↑,故答案为:Al4C3+12H2O═4Al(OH)3↓+3CH4↑.
点评 本题考查元素周期表的结构及应用,为高频考点,侧重于学生自学能力及类比解决问题的能力,注意把握“对角线”规则,题目难度中等.

练习册系列答案
相关题目
11.下列有关物质检验的实验结论正确的是( )
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入硝酸钡溶液,有白色沉淀生成,滴入稀硝酸,沉淀未消失 | 该溶液中一定含有SO42- |
| B | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 | 该物质一定属于醛类 |
| A. | A | B. | B | C. | C | D. | D |
6.某饱和氯化钠溶液的体积为VmL,密度为ρg/cm3,质量分数为w,物质的量浓度为cmol/L,溶液中所含氯化钠的质量为mg.下列选项正确的是( )
| A. | 该温度下,氯化钠的溶解度S=$\frac{w}{1-w}$g | |
| B. | 溶液中溶质的物质的量浓度c(NaCl)=$\frac{m}{58.5V}$mol/L | |
| C. | 溶液中溶质物质的量浓度c(NaCI)=$\frac{10ρw}{58.5}$mol/L | |
| D. | 溶液中溶质的质量分数w=$\frac{58.5c}{10ρ}$% |
13.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了27g.常温下各烧杯中溶液的pH与电解时间(t)的关系如图2.据此回答下列问题:
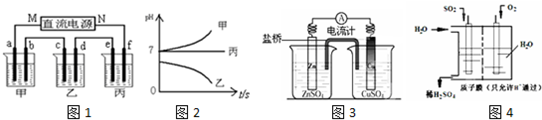
(1)M为电源的负极(填“正”或“负”),甲电解质为NaCl(填化学式).
(2)写出丙烧杯中反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(3)有人设想用图3所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的M(填“M”或“N”)极.
(4)有人设想用图4所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料.该设想中负极的电极反应式为SO2+2H2O-2e-=4H++SO42-.
(5)以甲醇、空气,氢氧化钾溶液为原料,石墨为电极,可构成燃料电池;已知该燃料电池的总反应式是:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时,正极区溶液的PH增大 (填“增大”,“减小”或“不变”)该电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
(6)用上述燃料电池进行粗铜的精炼,粗铜应连接电源的正极,该粗铜精炼电解池的阴极反应式为Cu2++2e-=Cu.
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

(1)M为电源的负极(填“正”或“负”),甲电解质为NaCl(填化学式).
(2)写出丙烧杯中反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(3)有人设想用图3所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的M(填“M”或“N”)极.
(4)有人设想用图4所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料.该设想中负极的电极反应式为SO2+2H2O-2e-=4H++SO42-.
(5)以甲醇、空气,氢氧化钾溶液为原料,石墨为电极,可构成燃料电池;已知该燃料电池的总反应式是:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时,正极区溶液的PH增大 (填“增大”,“减小”或“不变”)该电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
(6)用上述燃料电池进行粗铜的精炼,粗铜应连接电源的正极,该粗铜精炼电解池的阴极反应式为Cu2++2e-=Cu.
10.给试管里的固体加热,下列操作中错误的是( )
| A. | 如试管外壁有水,应在加热前擦拭干净 | |
| B. | 试管均匀受热,即先进行预热,然后把灯焰固定在放固体的部位加热 | |
| C. | 加热时不要使试管与灯心相接触 | |
| D. | 加热完毕,立即用冷水冲洗试管 |
11.如图所示微观变化的化学反应类型,与下列反应的反应类型一致的是( )
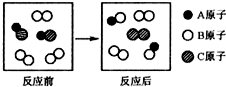

| A. | 2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2 | B. | 2HI+Cl2═2HCl+I2 | ||
| C. | CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO | D. | 2HCl+CuO═CuCl2+H2O |