��Ŀ����
����Ŀ���л���A��B��C��D��E��F֮�������µ�ת����ϵ��
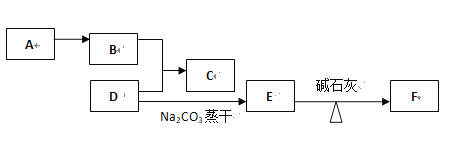
��֪F�ǽṹ�������C�Ǿ���ˮ����ζ��Һ�塢������ˮ����������4��̼ԭ�ӣ�A����Ҫ�Ļ���ԭ�ϣ��Ǻ�������ʯ�ͻ�����չˮƽ�ı�־����д����
��1��F�Ľṹʽ________ ����������������Ӧ�IJ�����_________�����������
��2�� B+D��C�Ļ�ѧ����ʽ___________________________________;
��3��A��B�Ļ�ѧ����ʽ________________��Ӧ����_____________;
��4������ȲΪԭ���ƾ�����ϩ��
����һ����ѧ����ʽ _________________��Ӧ����_____________;
���������ѧ����ʽ _________________��Ӧ����_____________;
��5��������F��ͬϵ�д�����������ͬ���칹��______________________________
���𰸡� ![]() ����� CH3COOH + CH3CH2OH
����� CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O CH2=CH2+H2O
CH3COOCH2CH3+ H2O CH2=CH2+H2O![]() CH3CH2OH �ӳɷ�Ӧ CH��CH+HCl
CH3CH2OH �ӳɷ�Ӧ CH��CH+HCl![]() CH2=CHCl �ӳɷ�Ӧ nCH2=CHCl
CH2=CHCl �ӳɷ�Ӧ nCH2=CHCl![]()
![]() �Ӿ۷�Ӧ CH3CH2CH2CH2CH3��CH3CH(CH3)CH2CH3��C(CH3)4
�Ӿ۷�Ӧ CH3CH2CH2CH2CH3��CH3CH(CH3)CH2CH3��C(CH3)4
�����������������A����Ҫ�Ļ���ԭ�ϣ��Ǻ�������ʯ�ͻ�����չˮƽ�ı�־��A����ϩ��D����̼���Ʒ�Ӧ��D���ᣬE�������ƣ�F�ǽṹ�������F�Ǽ��飬����E�������ƣ�D�����C�Ǿ���ˮ����ζ��Һ�塢������ˮ��C�����࣬��������4��̼ԭ�ӣ�B��D����C������C������������B���Ҵ���
�������������Ϸ�������1��F�Ǽ������ṹʽΪ![]() ��������������ȡ����Ӧ�IJ�����һ�ȼ��������ȼ��������ȼ��������Ȼ�̼�Ļ��������2���Ҵ������ᷢ��������Ӧ�������������ķ���ʽ��CH3COOH + CH3CH2OH
��������������ȡ����Ӧ�IJ�����һ�ȼ��������ȼ��������ȼ��������Ȼ�̼�Ļ��������2���Ҵ������ᷢ��������Ӧ�������������ķ���ʽ��CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O ;
CH3COOCH2CH3+ H2O ;
��3����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�����ѧ����ʽ��CH2=CH2+H2O![]() CH3CH2OH����4������ȲΪԭ���ƾ�����ϩ��
CH3CH2OH����4������ȲΪԭ���ƾ�����ϩ��
����һ����Ȳ���Ȼ��ⷢ���ӳɷ�Ӧ��������ϩ����ѧ����ʽCH��CH+HCl![]() CH2=CHCl�������������ϩ�����Ӿ۷�Ӧ���ɾ�����ϩ����ѧ����ʽ��nCH2=CHCl
CH2=CHCl�������������ϩ�����Ӿ۷�Ӧ���ɾ�����ϩ����ѧ����ʽ��nCH2=CHCl![]()
![]() ����5�����������ͬ���칹����CH3CH2CH2CH2CH3��CH3CH(CH3)CH2CH3��C(CH3)4��
����5�����������ͬ���칹����CH3CH2CH2CH2CH3��CH3CH(CH3)CH2CH3��C(CH3)4��

 �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д� ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д�����Ŀ����ش��������⣺
(1)��Feԭ�ӵĺ�������Ų�ʽΪ[Ar]_________,Mgԭ�Ӻ���ռ������ܲ���ӵĵ���������ͼ��״Ϊ_________��
��As��±������۵����£�
AsCl3 | AsBr3 | AsI3 | |
�۵�/K | 256.8 | 304 | 413 |
����±�����۵�����ԭ����_________,AsCl3���ӵ����幹��Ϊ_________��
(2)ά����B1����Ϊ��ø�����ǵĴ�л�����б�����ϵͳ�����á������ʵĽṹʽΪ

���¹���ά����B1��˵����ȷ����________��
A��ֻ���Ҽ��ͦм�
B�����й��ۼ��������Ӽ�
C�������ʵ��۵���ܸ���NaCl
D������������������
(3)ά����B1��������ˮ�Ĺ�����Ҫ�˷���������������________��
A�����Ӽ������ۼ� B�����Ӽ�����������ۼ�
C����������»��� D�����Ӽ�����������»���