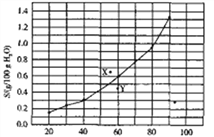
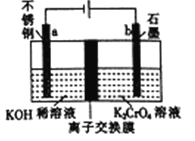
题目内容
【题目】铬是由法国化学家沃克兰于1798年在巴黎发现的。目前铬被广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。
(1)铬元素基态原子的电子排布式为____________,其核外未成对电子数为__________。
(2)金属铬的第二电离能(ICr)和锰的第二电离能(IMn)分别为1590.6kJ·mol-1、1509.0 kJ·mol-1,ICr>IMn的原因是__________。
(3)雷氏盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2].H2O是一种易溶于水和乙醇的暗红色固体。
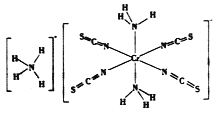
①雷氏盐中铬元素的化合价为_______,NH3与铬离子形成的化学键为__________。
②NCS-的立体构型是________,其中碳原子的杂化轨道类型为_______。SO2、CO2、BaCl2、SCl2四种分子中,与NCS-互为等电子体的是_____________。
③乙醇的沸点比溴乙烷高,其原因是__________。
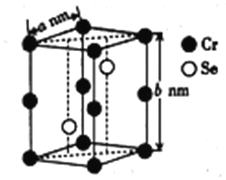
(4)硒化铬的晶胞结构如图所示,晶胞参数为anm和bnm,则硒化铬的密度为____________g·cm-3(列出表达式即可)。
【答案】 1s22s22p63s23p63d54s1(或[Ar]3d54s1) 6 铬的第二电离能是失去半充满3d5上的电子,锰的第二电离能是失去3d6上的电子变为半充满状态 +3 配位键 直线形 sp CO2、BeCl2 乙醇分子间形成氢键 ![]() (或
(或![]() )
)
【解析】(1). 铬元素是24号元素,其价电子排布非常特别,基态原子的电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1),其3d和4s都是半充满状态,3d轨道的5个电子分占5个轨道并且自旋状态相同,这样排布体系能量较低,其核外未成对电子数为6(3d5个、4s1个)。
(2). 金属铬失去第1个电子后,外围电子结构为3d5,3d轨道处于较稳定的半充满状态,而锰失去第1个电子后外围电子结构为3d54s1,4s轨道的电子能量较低容易失去,失去后变为半充满状态,所以铬的第二电离能高于锰。答案:ICr>IMn的原因是铬的第二电离能是失去半充满3d5上的电子,锰的第二电离能是失去3d6上的电子变为半充满状态。
(3). 由雷氏盐(Reinecke salt)的化学式NH4[Cr(NCS)4(NH3)2].H2O可知,它是一种配合物,其外界是一个铵根NH4+,带一个单位的正电荷,所以其内界必然带一个单位的负电荷,内界有两种配体,分别是氨分子和硫氰根离子,氨分子不带电荷,硫氰根离子带一个单位的负电荷,所以中心原子铬带3个单位的正电荷,铬的化合价是+3。①雷氏盐中铬元素的化合价为+3,NH3与铬离子形成的化学键为配位键或共价键。②由雷氏盐的结构式可知,NCS-的中心原子C原子形成了两个双键,每个双键含一个σ键和一个π键,所以NCS-的立体构型是直线形,其中碳原子的杂化轨道类型为sp 杂化。NCS-中有3个原子,价电子数是16,所以SO2、CO2、BaCl2、SCl2四种分子中,与NCS-互为等电子体的是CO2、BeCl2。
③乙醇和溴乙烷都是分子晶体,它们的分子间都有范德化力,但是乙醇分子间还能形成氢键,氢键是比范德化力更强的分子间作用力,所以乙醇的沸点比溴乙烷高,其原因是乙醇分子间形成氢键。
(4). 由硒化铬的晶胞结构可求出每个晶胞中有2个铬原子和2个硒原子。由晶胞参数为anm和bnm可算出每个晶胞的体积为a2b nm3即a2b ![]() 10-21cm3,硒化铬的摩尔质量为131g/mol,取1mol硒化铬的晶胞来计算它的密度,1mol晶胞中有2molCrSe,则其质量为262g,体积为NAa2b
10-21cm3,硒化铬的摩尔质量为131g/mol,取1mol硒化铬的晶胞来计算它的密度,1mol晶胞中有2molCrSe,则其质量为262g,体积为NAa2b ![]() 10-21cm3,则硒化铬的密度为
10-21cm3,则硒化铬的密度为![]() g·cm-3
g·cm-3