题目内容
X元素的阳离子和Y元素的阴离子具有相同的核外电子层结构,下列叙述正确的是
| A.原子序数X<Y | B.原子半径X<Y |
| C.离子半径X>Y | D.原子最外层电子数X<Y |
D
试题分析:X元素的阳离子和Y元素的阴离子具有相同的核外电子层结构,则X是金属,Y是非金属性,位于X的上一周期的右侧,则原子序数X>Y ,A不正确;B不正确,原子半径是X>Y;核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,C不正确,离子半径应该是X<Y,所以正确的答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型,试题基础性强,侧重能力的培养和基础知识的巩固。该题主要是以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目
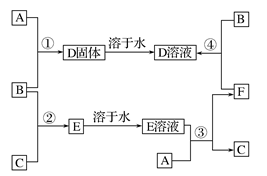
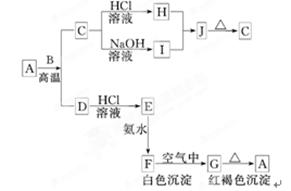

 ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
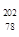 Pt的说法正确的是
Pt的说法正确的是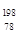 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
