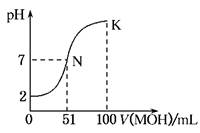
题目内容
(8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ka= 1.75×10-5
碳酸 Ka1= 4.30×10-7 Ka2 = 5.61×10-11
亚硫酸 Ka1= 1.54×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ;
碳酸的第一步电离比第二步电离 (填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > >
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
醋酸 Ka= 1.75×10-5
碳酸 Ka1= 4.30×10-7 Ka2 = 5.61×10-11
亚硫酸 Ka1= 1.54×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ;
碳酸的第一步电离比第二步电离 (填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > >
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
| A.c(CH3COO-) | B.c(H+) | C.醋酸的电离平衡常数 | D.醋酸的电离度 |
(1)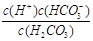 容易 (2)H2CO3 > HSO3- > HCO3- (3) A D
容易 (2)H2CO3 > HSO3- > HCO3- (3) A D
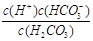 容易 (2)H2CO3 > HSO3- > HCO3- (3) A D
容易 (2)H2CO3 > HSO3- > HCO3- (3) A D(1)碳酸的第一步电离方程式为H2CO3 H++HCO3-,所以电离平衡常数表达式为Ka1 =
H++HCO3-,所以电离平衡常数表达式为Ka1 = 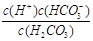 。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
(2)酸电离平衡常数越大,说明酸越强。所以根据电离平衡常数可知,H2CO3、HCO3-和HSO3-的酸性强弱顺序为H2CO3 > HSO3- > HCO3-。
(3)加入乙酸,增大氢离子浓度,抑制醋酸的电离,所以选项AD减小,B增大,C不变。
 H++HCO3-,所以电离平衡常数表达式为Ka1 =
H++HCO3-,所以电离平衡常数表达式为Ka1 = 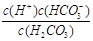 。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。(2)酸电离平衡常数越大,说明酸越强。所以根据电离平衡常数可知,H2CO3、HCO3-和HSO3-的酸性强弱顺序为H2CO3 > HSO3- > HCO3-。
(3)加入乙酸,增大氢离子浓度,抑制醋酸的电离,所以选项AD减小,B增大,C不变。

练习册系列答案
相关题目
 中和等量NaOH时消耗的体积:①________②;与足量的Zn反应生成H2的物质的量:① ________②。
中和等量NaOH时消耗的体积:①________②;与足量的Zn反应生成H2的物质的量:① ________②。