题目内容
某温度下,100 mL 0.4 mol/L醋酸溶液与足量Zn粒反应生成H2的速率v(H2)=0.01mol/(L·min)。下列有关说法正确的是 ( )
| A.为了减缓反应速率,但又不影响生成H2的总量,可向该溶液中加入少量CaCO3固体 |
| B.为了减缓反应速率,但又不影响生成H2的总量,可向该溶液中加入10 mL 0.1 mol/L醋酸溶液 |
| C.为了减缓反应速率,但又不影响生成H2的总量,可向该溶液中加入少量NaNO3溶液 |
| D.若向该溶液中加入少量醋酸钠固体,反应速率可能变成v(H2)="0.3" mol/(L·h) |
D
考查外界条件对反应速率的影响。碳酸钙可以和醋酸反应放出CO2气体,所以加入碳酸钙,会影响氢气的总量。加入醋酸会增加醋酸的物质的量,则产生的氢气会增加。在酸性溶液中,硝酸钠和锌反应不能生成氢气,而是生成NO。加入醋酸钠固体后,醋酸钠会结合氢离子生成难电离的醋酸,降低氢离子的浓度。而随着反应的进行,醋酸会逐渐电离出氢离子,所以答案是D。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
 H++A-,回答下列问题:
H++A-,回答下列问题: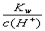 =0.1 mol/L的溶液中,Na+、CO32-、Cl-一定能大量共存
=0.1 mol/L的溶液中,Na+、CO32-、Cl-一定能大量共存