题目内容
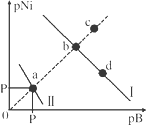
【题目】室温时,用0.100mol· L -1AgNO3溶液滴定50.0mL0.0500mol· L -1NaCl溶液的滴定曲如右图所示[pCl=-lg(Cl-)]。下列有关描述错误的是

A. 室温时Ksp(AgCl)的数量级为10-10
B. 室温时,各点Ksp(AgCl)的关系:a=b=c
C. 相同实验条件下,若改用0.0400mol· L-1 NaCl溶液,反应终点b移动到d
D. 相同实验条件下,若改用0.0500ml· L-1 NaBr溶液,反应终点b向e方向移动
【答案】D
【解析】
A.选取横坐标为50mL的点,此时向50.0mL0.0500mol· L -1NaCl溶液中,加入50mL 0.100mol· L -1AgNO3溶液,所以计算出此时溶液中过量的Ag+浓度为0.025 mol· L -1,由图示得到此时Cl—约为1×10-8 mol· L -1,所以Ksp(AgCl)约为0.025×10-8=2.5×10-10,所以其数量级为10-10,故A正确;
B.由于Ksp(AgCl)极小,因此向溶液中滴加AgNO3溶液就会有沉淀析出,溶液一直是氯化银的饱和溶液,在一定温度时,,Ksp(AgCl)是个常数,故各点Ksp(AgCl)的关系:a=b=c,故B正确;
C. 滴定的过程是用硝酸银滴定NaCl溶液,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL 0.05mol/L的NaCl溶液改为50m L 0.0400mol. L-1的NaCl溶液,此时溶液中的氯离子的物质的量是原来的0.8倍,所以滴定终点需要加入的硝酸银的量也是原来的0.8倍,因此应该由b点的25mL变为25×0.8=20mL,而d点对应的是20 mL,故C正确;
D. 卤化银从氯化银到碘化银的溶解度应该逐渐减小,所以Ksp(AgCl)应该大于Ksp(AgBr),将50mL 0.0500mol/L的NaCl溶液改为50m L 0.0500mol/LNaBr的溶液,这是将溶液中的氯离子换为等物质的量的溴离子,因为银离子和氯离子或溴离子都是1:1沉淀的,所以滴定终点的横坐标不变,但是因为溴化银更难溶,所以终点时,溴离子的浓度应该比终点时氯离子的浓度更小,所以反应终点不可能b向e方向移动,故D错误;
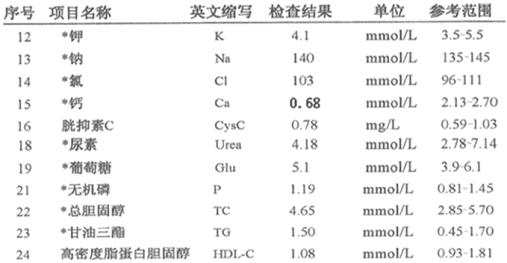
故选D。