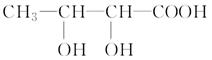题目内容
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤气变换反应③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反应④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是 。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为 ,该温度下,平衡常数K= ;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是 。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为 ;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子 mol
(1)2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△=-204.7 kJ/mol,
(2)ac (3)50% 0.25 cd (4)CH3OCH3+3H2O-12e-=2CO2+12H+, 0.5
解析试题分析:由已知的方程式①×2+④得2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△=-204.7 kJ/mol,
(2)由反应①可知ac说明反应达平衡状态。
(3)根据反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1当放热为49k J时消耗甲醇
4mol 4mol 2mol 2mol
结合平衡常数k=c(CH3OCH3)c(H2O)/
C2(CH3OH)得0.25,当再冲入2mol甲醇时化学平衡不会移动且平衡常数不变,确定C对,压强为原来的1.25倍。
(4)电解质为酸性电池的负极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+,正极反应式为
4H++O2+4e-=4H2O,消耗2.8L氧气时转移电子为0.5mol。
考点:盖斯定律、化学平衡状态的标志、化学平衡常数、原电池原理、电子反应式的书写。

以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4 Na(g)+ 3CO2(g)
 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol(1)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min, 金属钠的物质的量减少了0.2mol,则10min内CO2的平均反应速率为 。
(2)高压下有利于金刚石的制备,理由是 。
(3)由CO2(g)+ 4Na(g)=2Na2O(s)+ C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
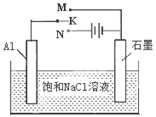
(4)下图开关K接M时,石墨电极反应式为 。
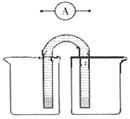
(5)请运用原电池原理设计实验,验证Cu2+、Ag+氧化性的强弱。
在方框内画出实验装置图,要求用烧杯和盐桥(在同一烧杯中,
电极与溶液含相同的金属元素),并标出外电路电子流向。
化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)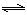 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g) 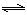 2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g) 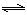 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)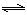 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)
 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :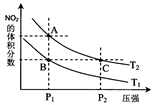
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
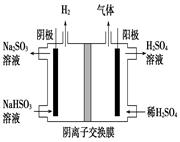
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。
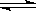 N2+2CO2,则该反应的化学平衡常数表达式K=________。
N2+2CO2,则该反应的化学平衡常数表达式K=________。
 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。 H++CN-电离的ΔH为 kJ·mol-1
H++CN-电离的ΔH为 kJ·mol-1 O2(g)=CO(g)
O2(g)=CO(g) 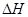 ="-111.0" KJ·mol-1
="-111.0" KJ·mol-1 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol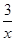 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究: 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。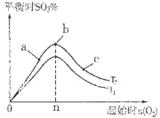

 NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。