题目内容
【题目】某实验需要500mL、0.1mol/L的NaOH溶液,现通过如下操作配制:
(1)①把称量好的g固体NaOH放入小烧杯中,加适量蒸馏水溶解.为加快溶解可以使用(填仪器名称)搅拌;②把①所得溶液冷却到室温后,小心转入(填仪器名称和规格);
③继续加蒸馏水至液面至刻度线12cm处,改用(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤玻璃棒和烧杯23次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀.
(2)操作步骤正确的顺序是(填序号).
(3)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为 .
(4)若取出20mL配好的NaOH溶液,加蒸馏水稀释成c(Na+)=0.01mol/L的溶液,则稀释后溶液的体积为mL.
(5)在配制500mL、0.1mol/L的NaOH溶液时,下列操作中的会导致结果偏低(请用序号填写).①用滤纸称量NaOH②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线④定容时仰视刻度线
⑤干净的容量瓶未经干燥就用于配制溶液.
【答案】
(1)2.0;玻璃棒;500mL容量瓶;胶头滴管
(2)①②④③⑤
(3)0.38%
(4)200
(5)①②④
【解析】解:(1)①需要的氢氧化钠的物质的量n=cV=0.1mol/L×0.5L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g,搅拌所用的仪器是玻璃棒,所以答案是:2.0;玻璃棒;②容量瓶只有一条刻度线,只能用于配制其对应规格的体积的溶液,根据配制的是500mL0.1mol/L的NaOH溶液,故选择的容量瓶为500mL容量瓶,所以答案是:500mL容量瓶;③定容时先向容量瓶中注水至液面至刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低点与刻度线相切,所以答案是:胶头滴管;(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是①②④③⑤,所以答案是:①②④③⑤;(3)设溶液的质量分数为ω,根据所配溶液的物质的量浓度C= ![]() =
= ![]() =0.1mol/L,解得ω=0.0038即0.38%,所以答案是:0.38%;(4)在氢氧化钠溶液中,c(NaOH)=c(Na+)=0.01mol/L,设稀释后溶液的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:20mL×0.1mol/L=0.01mol/L×VmL,解得V=200mL,所以答案是:200;(5)①由于氢氧化钠易潮解,用滤纸称量NaOH会导致氢氧化钠潮解且很难将滤纸上的氢氧化钠全部倒入烧杯,引起氢氧化钠的损失,导致浓度偏低,故①选; ②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,会导致溶质的损失,浓度偏低,故②选;③定容时俯视刻度线,则导致溶液的体积偏小,浓度偏高,故③不选;④定容时仰视刻度线,则导致溶液体积偏大,浓度偏低,故④选;⑤若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故⑤不选;故选①②④.
=0.1mol/L,解得ω=0.0038即0.38%,所以答案是:0.38%;(4)在氢氧化钠溶液中,c(NaOH)=c(Na+)=0.01mol/L,设稀释后溶液的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:20mL×0.1mol/L=0.01mol/L×VmL,解得V=200mL,所以答案是:200;(5)①由于氢氧化钠易潮解,用滤纸称量NaOH会导致氢氧化钠潮解且很难将滤纸上的氢氧化钠全部倒入烧杯,引起氢氧化钠的损失,导致浓度偏低,故①选; ②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,会导致溶质的损失,浓度偏低,故②选;③定容时俯视刻度线,则导致溶液的体积偏小,浓度偏高,故③不选;④定容时仰视刻度线,则导致溶液体积偏大,浓度偏低,故④选;⑤若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故⑤不选;故选①②④.

【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO为原料,可以制取氧化锌和金属锌)
(1)Ⅰ、制取氯化锌主要工艺如图: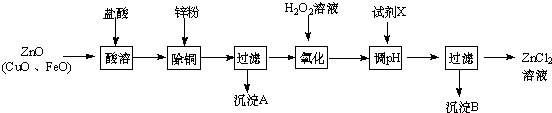
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算).
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Zn2+ | 5.2 | 6.4 |
Fe2+ | 5.8 | 8.8 |
①加入H2O2溶液发生反应的离子方程式为 .
②流程图中,为了降低溶液的酸度,试剂X不可以是(选填序号);pH应调整到
a.ZnO b.Zn(OH)2 c.Zn2(OH)2CO3 d.ZnSO4
③氯化锌能催化乳酸(2﹣羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 , 聚乳酸的结构简式为 .
(2)Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq)},然后电解浸取液.①以石墨作电极电解时,阳极产生的气体为;阴极的电极反应为 .
②炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是

