题目内容
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO为原料,可以制取氧化锌和金属锌)
(1)Ⅰ、制取氯化锌主要工艺如图: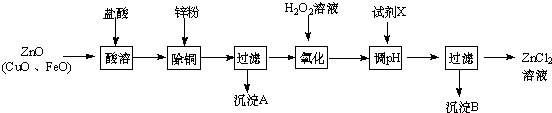
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算).
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Zn2+ | 5.2 | 6.4 |
Fe2+ | 5.8 | 8.8 |
①加入H2O2溶液发生反应的离子方程式为 .
②流程图中,为了降低溶液的酸度,试剂X不可以是(选填序号);pH应调整到
a.ZnO b.Zn(OH)2 c.Zn2(OH)2CO3 d.ZnSO4
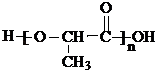
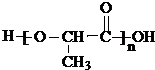
③氯化锌能催化乳酸(2﹣羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 , 聚乳酸的结构简式为 .
(2)Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq)},然后电解浸取液.①以石墨作电极电解时,阳极产生的气体为;阴极的电极反应为 .
②炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是
【答案】
(1)2Fe2++H2O2+2H+=2Fe3++2H2O;d;3.2≤pH<5.2;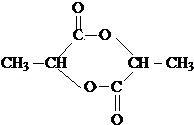 ;
;
(2)O2;[Zn(OH)4]2﹣+2e﹣=Zn+4OH﹣;氧化铜、氧化亚铁不溶于碱溶液中
【解析】解:炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,沉淀A为Cu,滤液中含有锌离子和亚铁离子,加入过氧化氢把亚铁离子氧化为铁离子,再加ZnO(或氢氧化锌等)调节pH,使铁离子转化为氢氧化铁沉淀,过滤除去沉淀,得到氯化锌溶液.(1)①加过氧化氢亚铁离子氧化为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;②调节pH时要消耗氢离子,但是不能引入杂质,ZnO、Zn(OH)2、Zn2(OH)2CO3均与氢离子反应生成锌离子,消耗氢离子的同时不引人杂质,ZnSO4不能与氢离子反应,所以不能调节pH;调节pH使铁离子转化为沉淀,而锌离子不沉淀,由表中数据可知pH≥3.2时,铁离子完全沉淀,而锌离子开始沉淀的pH为5.2,所以要调节pH为3.2≤pH<5.2;所以答案是:d;3.2≤pH<5.2;③ ![]() 分子中含有﹣COOH和﹣OH,两分子的乳酸分子间发生酯化反应,反应产物为
分子中含有﹣COOH和﹣OH,两分子的乳酸分子间发生酯化反应,反应产物为 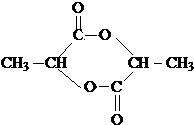 ;
; ![]() 分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为:
分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为:  ;所以答案是:
;所以答案是:  ;
;  ;(2)①石墨作电极电解时,阳极氢氧根离子失电子生成氧气与水阳极反应为:4OH﹣﹣4e﹣═2H2O+O2↑,阴极上[Zn(OH)4]2﹣得电子生成Zn与氢氧根离子,则阴极的电极方程式为:[Zn(OH)4]2﹣+2e﹣=Zn+4OH﹣所以答案是:O2;[Zn(OH)4]2﹣+2e﹣=Zn+4OH﹣;②ZnO能溶液强碱溶液,CuO和FeO不溶于碱溶液,酸溶液与ZnO、CuO、FeO均能反应,所以炼锌烟尘采用碱溶,而不采用酸溶后电解,
;(2)①石墨作电极电解时,阳极氢氧根离子失电子生成氧气与水阳极反应为:4OH﹣﹣4e﹣═2H2O+O2↑,阴极上[Zn(OH)4]2﹣得电子生成Zn与氢氧根离子,则阴极的电极方程式为:[Zn(OH)4]2﹣+2e﹣=Zn+4OH﹣所以答案是:O2;[Zn(OH)4]2﹣+2e﹣=Zn+4OH﹣;②ZnO能溶液强碱溶液,CuO和FeO不溶于碱溶液,酸溶液与ZnO、CuO、FeO均能反应,所以炼锌烟尘采用碱溶,而不采用酸溶后电解,
所以答案是:氧化铜、氧化亚铁不溶于碱溶液中.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案