题目内容
某元素的原子核外有3个电子层,最外层有4个电子,该原子核内的质子数为( )。
| A.14 | B.15 | C.16 | D.17 |
A
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
| A.元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 |
| B.39g Z2Y2中含有的离子数约为1.204×1024 |
| C.元素Z、R的氧化物的水化物之间相互反应生成的盐一定是正盐 |
| D.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
| A.该粒子不显电性 | B.该粒子质量数为4 |
| C.在周期表中与氢元素占同一位置 | D.该粒子质量比氢原子大 |
下列说法正确的是( )。
| A.第二周期元素从C到F,非金属性逐渐减弱 |
| B.第三周期元素从Na到Cl,原子半径逐渐增大 |
| C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱 |
| D.LiOH、NaOH、KOH的碱性依次逐渐增强 |
已知X、Y均为1~18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为( )。
| A.19 | B.18 | C.27 | D.9 |
某元素R的气态氢化物的化学式为H2R,则R的最高价氧化物对应水化物化学式是( )。
| A.H2RO3 | B.HRO3 | C.H3RO4 | D.H2RO4 |
核外电子层结构相同的一组粒子是( )。
| A.Mg2+、Al3+、Cl-、Ne | B.Na+、F-、S2-、Ar |
| C.K+、Ca2+、S2-、Ar | D.Mg2+、Na+、Cl-、S2- |
短周期元素X和Y可以形成XY4型化合物,若X的原子序数为m,Y的原子序数为n,则m和n的相互关系不可能为( )。
| A.m-13=n | B.n+5=m | C.m+8=n | D.n-11=m |
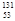 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中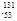 I的化学性质与
I的化学性质与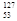 I相同
I相同