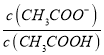题目内容
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
【答案】C
【解析】
A. 在标准状况下庚烷为液态,不能根据气体摩尔体积来计算其物质的量和分子个数,A错误;
B. S2-在溶液中能水解为HS-和H2S,根据物料守恒可知,溶液中的S2-、HS-和H2S个数共为0.1NA个,B错误;
C.![]() 与D2O的摩尔质量均为20 g/mol,每种微粒分子中都含10个中子,因此4.0 g混合物的物质的量为0.2 mol,因此0.2 mol混合物中含2NA个中子,C正确;
与D2O的摩尔质量均为20 g/mol,每种微粒分子中都含10个中子,因此4.0 g混合物的物质的量为0.2 mol,因此0.2 mol混合物中含2NA个中子,C正确;
D. 二氧化锰只能和浓盐酸反应,随着反应的进行,盐酸浓度降低变为稀盐酸,反应就不再发生,故浓盐酸中溶质不能反应完全,因此转移的电子数小于0.3NA个,D错误;
故合理选项是C。

【题目】碳和氮的化合物在生产、生活中广泛存在。请回答下列问题:
(1)资料显示,可用次氯酸钠处理废水中的氨氮![]() ,使其转化为氮气除去。其主要反应如下
,使其转化为氮气除去。其主要反应如下
I.![]()
![]()
![]()
![]()
①以上反应中HClO的来源用化学用语解释是______。
②实验测得。废水中pH与氨氮去除率的关系如图所示。pH较高时,氨氮去除率下降的原因是___。

(2)甲酶是重要的化工原料,又可作为燃料,工业上可利用CO或![]() 来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | ||
|
|
|
|
|
|
|
|
|
|
|
| |||
①下列措施能使反应![]() 的平衡体系中
的平衡体系中![]() 增大的是______
增大的是______![]() 填字母代号
填字母代号![]() 。
。
A.将![]() 从体系中分离出去
从体系中分离出去![]() 充入
充入![]() ,使体系压强增大
,使体系压强增大
C.升高温度![]() 恒容时再充入1mol
恒容时再充入1mol![]()
![]()
②500℃时测得反应![]() 在某时刻
在某时刻![]() 、
、![]() 、
、![]() 、
、![]() 的浓度分別为
的浓度分別为![]() 、
、![]() 、
、![]() 、
、![]() ,则此时正
,则此时正![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() v
v![]() 逆
逆![]() 。
。
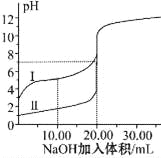
(3)常温下,在![]() 溶液中,反应
溶液中,反应![]() 的化学平衡常数
的化学平衡常数![]() ______。
______。![]() 已知:常温下,
已知:常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离衡常数
的电离衡常数![]() 、
、![]()
(4)电解硝酸上业的尾气NO可制备![]() ,其工作原理如图所示:
,其工作原理如图所示:

①阴极的电极反应式为______。
②将电解生成的![]() 全部转化为
全部转化为![]() ,则通入的
,则通入的![]() 与实际参加反应的NO的物质的量之比至少为___。
与实际参加反应的NO的物质的量之比至少为___。