题目内容
(12分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7)。
Ⅰ.测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
Ⅱ.有关①100mL0.1mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的OH-个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H2CO3) D.②溶液中:c(HCO3-)>c(H2CO3)
(2)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(3)常温下,现有pH均为11的标签模糊的NaOH和Na2CO3溶液,则NaOH溶液中由水电离出来的OH-浓度为Na2CO3溶液中水电离出来OH-浓度的 倍。丙同学设计如下实验予以区别:各取1mL两种溶液加水稀释至1L,分别测定其pH。请问丙同学是如何判断哪瓶溶液为Na2CO3溶液? ;丁同学各取1mL两种溶液,分别滴加少量AlCl3溶液观察有无沉淀或气体进行鉴别,则溶液滴加后同时产生沉淀和气体的反应离子方程式为 。
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.400 mol·L-1的Na2CO3溶液和0.200 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
(1)Ⅰ.玻璃棒(1分) Ⅱ.C(1分)
(2)红色褪去,产生白色沉淀 (2分) ;由于Ba2+ +CO32-=BaCO3↓,使得溶液中CO32-浓度减少,水解平衡CO32-+ H2O=HCO3-+OH-向左移动,OH-浓度减少,红色褪去。(2分) (1个离子方程式1分,文字说明1分)
(3)10-8(1分) pH值较大的是Na2CO3(1分)(其它合理答案也给分)
3CO32-+2Al3++3H2O=3CO2↑+2Al(OH)3↓(2分)
(4)4.96×10-8 (2分)
解析:(1)测定pH时必须用玻璃棒蘸取待测液滴在试纸上;因为在相同浓度的条件下,碳酸钠的电离程度大于碳酸氢钠的电离程度,即碳酸钠对水电离的促进程度大,A正确。根据水解方程式CO32-+H2O HCO3-+OH-、HCO3-+H2O
H2CO3+OH-,可知每消耗1mol CO32-水解后就生成2mol阴离子,而HCO3-的水解则是消耗1mol,就产生1mol,阴离子的个数是不变的,所以溶液中阴离子的物质的量浓度之和:②>①,B正确。碳酸氢钠显碱性,说明其水解程度大于其电离程度,所以c(CO32-)<c(H2CO3),C不正确。CO32-的水解主要以第一步水解为主,所以溶液中c(HCO3-)>c(H2CO3),D正确。
(2)碳酸钠水解显碱性方程式为CO32-+H2O HCO3-+OH-、HCO3-+H2O
H2CO3+OH-。滴加BaCl2溶液,Ba2+会结合CO32-生成BaCO3沉淀,使水解平衡向逆反应方向移动,碱性降低,红色会褪去。
(3)强碱氢氧化钠是抑制水的电离,pH为11,说明溶液中由水电离出的氢离子和OH-浓度均是10-11。而碳酸钠水解显碱性,是促进水的电离,所以溶液中由水电离出的OH-浓度为10-3,所以是前者的108倍。强碱溶液中不存在其电离平衡,当稀释100倍是氢氧化钠的pH将减小3个单位,即由11到8。而碳酸钠中存在水解平衡,稀释会促进水解,但碱性会降低,但会高于氢氧化钠的pH。由于铝离子和CO32-的水解相互促进,所以会产生氢氧化铝沉淀,同时生成CO2气体。
(4)等体积混合后,CO32-和Ca2+的浓度分别为0.200 mol·L-1和0.100 mol·L-1,此时二者之积是0.02>4.96×10-9,即会产生碳酸钙沉淀。因为碳酸钠过量,剩余碳酸钠的物质的量浓度是0.100
mol·L-1,根据溶度积常数的表达式可知混合后溶液中Ca2+浓度为![]() mol·L-1。
mol·L-1。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案| A、HF常用于雕刻玻璃,但其属于弱酸 | B、石英、玛瑙、水晶通常作为装饰品使用,其主要成分均为二氧化硅 | C、Na2CO3俗称纯碱,其可与盐酸反应,故可用于治疗人体内胃酸过多 | D、甲醛能使蛋白质变性,所以可用甲醛水溶液浸泡动物标本,以达到防腐的作用 |
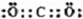
 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.