��Ŀ����
����Ŀ��ʵ��������ͼ��ʾװ���Ʊ�KClO��Һ������KOH��Fe��NO3��3��Һ��Ӧ�Ʊ���Ч��ˮ��K2FeO4��

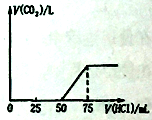
��֪��K2FeO4������ˮ������ŨKOH��Һ����0����5����ǿ������Һ�н��ȶ���
���Ʊ�KClO��K2FeO4��
��1��װ��C������ƿ���ڱ�ˮԡ�е�Ŀ���� ��
��2��C�еõ�����KClO������ƿ�ϵĵ���ȡ�£����μ���KOH��Һ��Fe��NO3��3��Һ��ˮԡ���Ʒ�Ӧ�¶�Ϊ25��������1.5 h����Һ��Ϊ�Ϻ�ɫ����K2FeO4�����÷�Ӧ�����ӷ���ʽΪ ���ټ��뱥��KOH��Һ�������Ϻ�ɫ���壬���ˣ��õ�K2FeO4�ֲ�Ʒ��
��3��K2FeO4�ֲ�Ʒ����Fe��OH��3��KCl�����ʣ����ᴿ����Ϊ��
����һ������K2FeO4�ֲ�Ʒ�������3 mol/L KOH��Һ�У�
�� ��
�� ��
�����衢���á����ˣ����Ҵ�ϴ��2��3�Σ����Ҵ�ϴ�ӵ�����_____________ .
������ո������и��
���ⶨ��Ʒ���ȡ�
��4����ȡ�ᴿ���K2FeO4��Ʒ0.2100 g���ձ��У�����ǿ�����Ǹ�������Һ�������ķ�ӦΪ��Cr��OH��4��+FeO42���TFe��OH��3��+CrO42��+OH�������˺��ټ�ϡ���������Һ��ǿ���ԣ���ʱ��Ӧ�����ӷ���ʽΪ�� ��
��5������4����Ӧ�����Һ���250 mL��Һ��ȡ��25.00 mL������ƿ����0.01000 mol/L����NH4��2Fe��SO4��2��Һ�ζ����յ㣬�ظ�����2�Σ�ƽ��������NH4��2Fe��SO4��2��Һ30.00 mL���ζ�ʱ���������ӷ�ӦΪ�� �������K2FeO4��Ʒ�Ĵ���Ϊ ��
���𰸡���1����ֹCl2��KOH��Ӧ����KClO3��
��2��3ClO��+2Fe3++10OH���T2FeO42��+3Cl��+5H2O��
����3ClO��+2Fe��OH��3+4OH���T2FeO42��+3Cl��+5H2OҲ������
��3������ ����Һ���ڱ�ˮԡ�У�����Һ�м��뱥��KOH��Һ
K2FeO4������ˮ����ֹ��ˮϴ��ʱ������ʧ
��4��CrO42��+2H+H2O+Cr2O72��
��5��Cr2O72��+6Fe2++14H+�T6Fe3++2Cr3++7H2O 94.3%
��������
�����������1��Cl2��KOH��Һ��20�����·�Ӧ����KClO���ڽϸ��¶���������KClO3�����Ա�ˮԡ��Ŀ���Ƿ�ֹCl2��KOH��Ӧ����KClO3��
��2������KClO�����μ���KOH��Һ��Fe��NO3��3��Һ������������ԭ��Ӧ����K2FeO4��KCl��ˮ�ȣ���Ӧ�����ӷ���ʽΪ3ClO-+2Fe3++10OH-�T2FeO42-+3Cl-+5H2O��
��3��K2FeO4������ˮ������ŨKOH��Һ�������ᴿK2FeO4�ֲ�Ʒʱ��������һ������K2FeO4�ֲ�Ʒ�������3 mol/L KOH��Һ�У������ˣ�������Һ���ڱ�ˮԡ�У�����Һ�м��뱥��KOH��Һ�������衢���á����ˣ���K2FeO4������ˮ����ֹ��ˮϴ��ʱ�����ܽ����ʧ�������Ҵ�ϴ��2��3�Σ�������ո������и��
��4������Һ�д���CrO42-+2H+H2O+Cr2O72-֮���ת��������ǿ��ٽ�ƽ�����������ƶ��������Һ��Cr2O72-��Ũ�ȣ�
��5���ζ�ʱCr2O72-������������������Һ���Fe2+ʱ������Ӧ�����ӷ�Ӧ����ʽΪ��Cr2O72-+6Fe2++14H+�T6Fe3++2Cr3++7H2O�����ݷ�ӦCr��OH��4-+FeO42-�TFe��OH��3��+CrO42-+OH-��Cr2O72-+6Fe2++14H+�T6Fe3++2Cr3++7H2O���ɵù�ϵʽ2FeO42-��Cr2O72-��6Fe2+�����������֪����NH4��2Fe��SO4��2�����ʵ���Ϊ0.03L��0.01000 mol/L=0.0003mol�����Ը�����ص�����Ϊ0.0003mol��1/3��198g/mol��250mL/25mL=0.198g������K2FeO4��Ʒ�Ĵ���0.198g��0.210g��100%=94.3%��