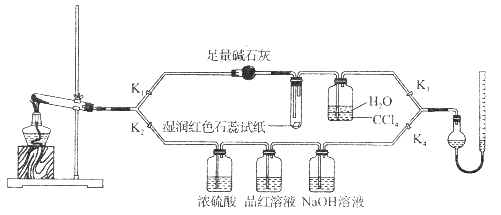
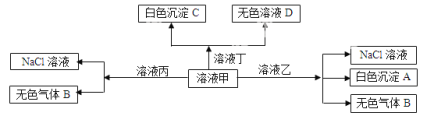
题目内容
【题目】部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )
A.V=44.8
B.原样品中Fe元素的质量分数为38.89%
C.滤液A中的阳离子为Fe2+、Fe3+、H+
D.样品中CuO的质量为4.0 g
【答案】B
【解析】
试题分析:A.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,其物质的量=![]() =0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量
=0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量![]() =0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol-0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故A错误;B.合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,故合金中Fe元素质量分数=
=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol-0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故A错误;B.合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,故合金中Fe元素质量分数=![]() ×100%=38.89%,故B正确;C.由于氧化性Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且硫酸足量,滤液A中阳离子为:Fe2+、H+,故C错误;D.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为
×100%=38.89%,故B正确;C.由于氧化性Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且硫酸足量,滤液A中阳离子为:Fe2+、H+,故C错误;D.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为![]() =0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故D错误;故选B。
=0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故D错误;故选B。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】
不同方案 | 所选幼苗状况及分组 | 幼苗的培养液(基) | 实验中光照条件 |
A | 长势相同幼苗分成两组 | 一组用清水培养,一组用镁溶液培养 | 充足光照 |
B | 长势不同幼苗分成两组 | 一组提供完全培养液,一组提供只缺镁的培养液 | 充足光照 |
C | 长势相同幼苗分成两组 | 一组提供完全配液,一组提供只缺镁的培养液 | 充足光照 |
D | 长势相同幼苗分成两组 | 一组用普通土壤培养,一组用加镁土壤培养 | 充足光照 |
A.A B.B C.C D.D
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol.L-1。(只要求写表达式,不需要计算)
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、 、 。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是 。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理