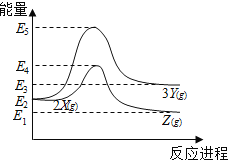
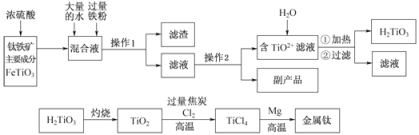
��Ŀ����
����Ŀ��ҽ���Ȼ��ƿ������������ơ�������������ҩ��Թ�ҵ̼��ƣ���������Na+��Al3+��Fe3+�����ʣ�����ҽҩ����ˮ���Ȼ��ƣ�CaCl2��2H2O����������Ϊ97.0%~103.0%������Ҫ�������£�
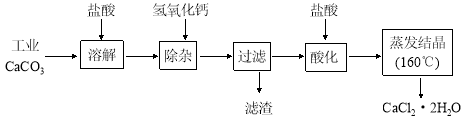
��1�����Ӳ����Ǽ����������ƣ�������Һ��pHΪ8.0~8.5���Գ�ȥ��Һ�е�����Al3+��Fe3+������Fe(OH)3�Ƿ������ȫ��ʵ�������__________________ ��
��2���ữ�����Ǽ������ᣬ������Һ��pHԼΪ4.0����Ŀ���У��ٽ���Һ�е�����Ca(OH)2ת��ΪCaCl2���ڷ�ֹCa2+������ʱˮ�⣻��___________________��
��3���ⶨ��Ʒ��Cl�������ķ����ǣ�a����ȡ0.7500g��Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ�b����ȡ25.00 mL������Һ����ƿ�У�c����0.05000mol/L AgNO3��Һ�ζ����յ㣬����AgNO3��Һ�����ƽ��ֵΪ20.39 mL��
�ٲ���a�н��ж��ݲ���ʱ����Ӧ ��ֱ�� ��
�������ⶨ������������Һ��ϴ��������__________________��
�ۼ���������Ʒ��CaCl2��2H2O����������Ϊ______________��
���������������ⶨ����Ʒ��CaCl2��2H2O����������ƫ�ߣ��ⶨ�����в��������ɺ��ԣ���ijͬѧ��Ϊƫ�ߵ�ԭ���������Ʒ�д���������NaCl��Ҫ��֤��ͬѧ�Ĺ۵�Ӧ���е�ʵ��Ϊ ����ʵ�����ƣ���
���𰸡���1��ȡ�����ϲ���Һ���μ�KSCN��Һ����������Ѫ��ɫ������Fe(OH)3������ȫ��2�֣�
��2����ֹ��Һ���տ����е�CO2��2�֣�
��3����ע�Ӱ�Һ�����ʹ���̶��ߣ�1�֣�����Һ�����ʹ���̶�����ƽ��1�֣�
����ʽ�ζ��ܣ�2�֣�����99.9%��2�֣�������ɫ��Ӧ��2�֣���
��������
�����������1��Fe3+��KSCN��Ӧ���ɺ�ɫ����Fe(SCN)3������Fe3+�Ƿ����,��ѡ��KSCN��Һ����������Ϊ��ȡ�����ϲ���Һ���μ�KSCN��Һ����������Ѫ��ɫ��������Fe(OH)3������ȫ����2��Ca(OH)2�����տ����е�CO2������CaCO3���������Լ������������Һ��pHΪ4.0�����ɷ�ֹ��Һ���տ�����CO2����3���ٱ�ҺΪ��������Һ����������ʽ�ζ��ܣ�����a�н��ж��ݲ���ʱ����Ӧע�Ӱ�Һ�����ʹ���̶��ߣ�ֱ����Һ�����ʹ���̶�����ƽ�������ڵζ�����ȷ�ζ���Һ���ⶨ��Һ�к���Cl-�����������Ҫ������ϴ���������ⶨ������������Һ��ϴ����������ʽ�ζ��ܣ�����Ʒ��n(Cl-)=0.05000mol/L��0.02039L��10=0.010195mol��������Ԫ���غ㣬�ɵ�n(AgCl)=2n��CaCl22H2O������n(CaCl22H2O)=0.0050975mol������m n��CaCl22H2O��=0.0050975mol��147g/mol=0.7493g������Ʒ��CaCl22H2O����������Ϊ����0.7493g��0.7500g����100%=99.9%������Ʒ�д���������NaCl�ᵼ��CaCl22H2O�����ʵ�������Ҫ��֤���к���NaClӦ���е�ʵ��Ϊ��ɫ��Ӧ�����л�ɫ���棬֤������NaCl��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�