题目内容
【题目】[选修3:物质结构与性质]磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性元件。
(1)基态铜原子的电子排布式为_____;高温时氧化铜会转化为氧化亚铜,原因是____________________________________。
(2)元素周期表第3周期中,第一电离能比P小的非金属元素是_______(填元素符号)。
(3)N、P、As同主族,三种元素最简单氢化物沸点由低到高的顺序为____________,原因是____________________________________。
(4)某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则P原子的杂化方式为_____,该多磷酸钠的化学式为______。

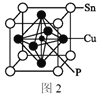
(5)某磷青铜晶胞结构如图2所示。
①则其化学式为______。
②该晶体中距离Sn原子最近的Cu原子有____个。
③若晶体密度为8.82 g·cm-3,最近的Cu原子核间距为______pm(用含NA的代数式表示,设NA表示阿伏加德罗常数的值)。
【答案】 1s22s22p63s23p63d104s1或[Ar]3d104s1 +1价铜的外围电子布为3d10的全充满结构,因此+1价铜比+2价铜的能量更低更稳定 Si和S PH3<AsH3<NH3 PH3和AsH3结构相似,相对分子质量越大,分子间作用力越强,沸点越高,因此AsH3的沸点高于PH3;NH3之间存在氢键,因此三者之中NH3的沸点最高 sp3杂化 NaPO3 SnCu3P 12 ![]()
【解析】(1)处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则,根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写,Cu是第四周期元素,为29号元素,其电子排布式为:[Ar]3d104s1;+1价铜的外围电子布为3d10的全充满结构,因此+1价铜比+2价铜的能量更低更稳定
(2)同一周期自左向右第一电离能有增大趋势,但磷元素3P轨道为半充满结构,较稳定,第VA族第一电离能大于其相邻元素,P元素的第一电离能比S元素的第一电离能要略大,故元素周期表第3周期中,第一电离能比P小的非金属元素是Si和S;
(3)N、P、As同主族,PH3和AsH3结构相似,相对分子质量越大,分子间作用力越强,沸点越高,因此AsH3的沸点高于PH3;NH3之间存在氢键,因此三者之中NH3的沸点最高,因此,
三种元素最简单氢化物沸点由低到高的顺序为PH3<AsH3<NH3;
(4)根据直链多磷酸钠的阴离子的无极单链状结构,其中磷氧四面体通过共有顶角氧原子相连,磷的成键电子对有4对,则P原子的杂化方式为sp3杂化;P、O原子个数比为1:3。根据化合价代数和为0可知,该物质中P、O、Na原子个数比为1:3:1。所以,该多磷酸钠的化学式为NaPO3。
(5)晶体中P原子位于中心,含有一个磷原子,立方体每个面心含一个Cu,每个Cu分摊给一个晶胞的占![]() ,立方体顶角Sn分摊给每个晶胞的原子为
,立方体顶角Sn分摊给每个晶胞的原子为![]() ,据此得到化学式;
,据此得到化学式;
②晶体中距离Sn原子最近Cu的原子在每个面心上;
③设立方体边长为x,铜原子间最近距离为a,则a2=![]() +
+![]() a=
a=![]() x,结合密度
x,结合密度![]() =
=![]() ,,V=x3,1个晶胞质量m=
,,V=x3,1个晶胞质量m=![]() g,计算x得到铜原子间最近距离。
g,计算x得到铜原子间最近距离。
详解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为: 1s22s22p63s23p63d104s1或[Ar]3d104s1;
因此,本题正确答案是: 1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2) 同一周期自左向右第一电离能有增大趋势,但磷元素3P轨道为半充满结构,较稳定,第VA族第一电离能大于其相邻元素,P元素的第一电离能比S元素的第一电离能要略大,故元素周期表第3周期中,第一电离能比P小的非金属元素是Si和S;
(3)N、P、As同主族,PH3和AsH3结构相似,相对分子质量越大,分子间作用力越强,沸点越高,因此AsH3的沸点高于PH3;NH3之间存在氢键,因此三者之中NH3的沸点最高,因此,
三种元素最简单氢化物沸点由低到高的顺序为PH3<AsH3<NH3;
(4)根据直链多磷酸钠的阴离子的无极单链状结构,其中磷氧四面体通过共有顶角氧原子相连,磷的成键电子对有4对,则P原子的杂化方式为sp3杂化;P、O原子个数比为1:3。根据化合价代数和为0可知,该物质中P、O、Na原子个数比为1:3:1。所以,该多磷酸钠的化学式为NaPO3。
故答案为:NaPO3;
(5)①根据晶胞结构图,晶体中P![]() ,立方体顶角Sn分摊给每个晶胞的原子为
,立方体顶角Sn分摊给每个晶胞的原子为![]() ,据此得到化学式SnCu3P,因此,本题正确答案是: SnCu3P;
,据此得到化学式SnCu3P,因此,本题正确答案是: SnCu3P;
②该晶体中距离Sn原子最近的Cu原子有12个;因此,本题正确答案是:12;③摩尔质量=342g/mol,则一个晶胞质量![]() g,设立方体边长为x,铜原子间最近距离为a,则a2=
g,设立方体边长为x,铜原子间最近距离为a,则a2=![]() +
+![]() a=
a=![]() x,结合密度
x,结合密度![]() =
=![]() ,V=x3=
,V=x3=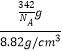 =
=![]() cm3,x=
cm3,x=![]() cm,a=
cm,a=![]() x=
x=![]() cm=
cm=![]() 1010pm,
1010pm,
因此,本题正确答案是:![]() 1010 。
1010 。

【题目】根据表中7种短周期元素的有关信息判断,下列说法错误的是![]()
![]()
元素编号 |
|
|
|
|
|
|
|
原子半径 |
|
|
|
|
|
|
|
最高化合价或最低化合价 |
|
|
|
|
|
|
|
A. 元素![]() 气态氢化物的稳定性大于元素
气态氢化物的稳定性大于元素![]() 气态氢化物的稳定性
气态氢化物的稳定性
B. 元素![]() 氢化物的沸点小于元素
氢化物的沸点小于元素![]() 氢化物的沸点
氢化物的沸点
C. 元素![]() 形成的化合物具有两性
形成的化合物具有两性
D. ![]() 可形成离子化合物
可形成离子化合物





